��Ŀ����
����Ŀ��ij��ѧ����Χ�ơ�����кͷ�Ӧ������ѧ���ֳ�����С�飬����ʦ�����¿�չ̽����������ǽ�ѧƬ�Σ�����μ�ѧϰ��������д�ո������пո�
��1������ʾʵ�顿��һ��������ϡH2SO4���뵽ʢ��NaOH��Һ��С�ձ��У� ��ѧ�����ݡ��÷�Ӧ�Ļ�ѧ����ʽ ��
��2����������⡿ʵ����δ�۲쵽��������ijͬѧ������ʣ���Ӧ����Һ��������ʲô�� ��������롿������ʣ���ҷ�������룮����ͬѧ�IJ������£����㲹�ϲ����ģ�
����һ��ֻ��Na2SO4
���������Na2SO4��H2SO4
����������Na2SO4��H2SO4��NaOH
�����ģ� ��
��3������ͬѧ��Ϊ��һ�ֲ����Dz������ģ��������IJ����� �� ������ ��
��4����ʵ��̽��������ͬѧȡ�ձ��е���Һ�������Թ��У��μӼ���CuSO4��Һ�������Ա仯����Һ��һ��û�� ��
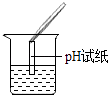
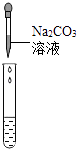
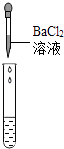
��5��Ϊ����֤������룬��ѧϰС�������ձ��е���Һ����ѡ������ʦ�ṩ��pH��ֽ��Na2CO3��Һ��BaCl2��Һ��������������������̽����
ʵ�鷽�� | ����Һ��pH | �μ�Na2CO3��Һ | �μ�BaCl2��Һ |
ʵ����� |
|
|
|
ʵ������ | ��ֽ��ɫ���Աȱ�ɫ����pH��7 | ������ɫ���� | |
ʵ����� | ��Һ����H2SO4 | ��Һ����H2SO4 | ��Һ����H2SO4 |
��6�����õ����ۡ�ͨ��̽����ȫ��ͬѧһ��ȷ�����������ȷ�ģ� �����۷�˼����ʦ��ͬѧ�����ö��ַ�������̽�������ҵó���ȷ���۸���϶���ͬʱָ����5���д����������Դ������ҷ�˼��ͬѧ�Ǿ�����˼�����˷�����������
��ʵ������еĴ��������
��ʵ�鷽����Ҳ��һ������ģ������ԭ���� ��
���𰸡�
��1��H2SO4+2NaOH=Na2SO4+2H2O
��2����Na2SO4��NaOH
��3����������H2SO4��NaOH����Һ�в��ܹ���
��4��NaOH
��5�������ݲ���
��6��pH��ֽ������Һ�У�Na2SO4��BaCl2��ӦҲ�����ɰ�ɫ����������֤��һ����H2SO4����
���������⣺��ѧ�����ݡ�������������Ʒ�Ӧ���������ƺ�ˮ����ѧ����ʽΪH2SO4+2NaOH�TNa2SO4 +2H2O����������롿������������Ʒ�Ӧ���������ƺ�ˮ��������ܹ��������������ƹ���ʱ����Ӧ����Һ�е�����Ϊ�����ƺ��������ƣ��ʲ�����Ϊ�������ƺ������ƣ���������������ͬʱ��������Ϊ���ܹ��棬�������Ӧ���ʲ������������� ��ʵ��̽��������ͭ���������Ʒ�Ӧ������������ͭ��ɫ�����������Һ�еμӼ���CuSO4��Һ�������Ա仯��˵����Һ��һ��û���������ƣ���Һ�������ᣬ�μ�̼���ƺ�̼���ƻ�����ᷴӦ���ɶ�����̼���壬��˻ῴ���������ݣ�
�����۷�˼���ٸ���ͼʾ�����жϣ������Һ��pHʱ��pH��ֽ����������Һ�У�Ӧ�ò�����պȡ������ҺͿ��pH��ֽ�ϣ��ڼ���һ������ʱҪ�ų��������ʵĸ��ţ�������Ҳ�����Ȼ�����Ӧ���ɰ�ɫ�������ʲ���֤����Һ��һ���������
���Դ��ǣ���ѧ�����ݡ�H2SO4+2NaOH=Na2SO4+2H2O��
��������롿��Na2SO4��NaOH����������H2SO4��NaOH����Һ�в��ܹ��棻
��ʵ��̽������4��NaOH����5�������ݲ�����
�����۷�˼����pH��ֽ������Һ�У���Na2SO4��BaCl2��ӦҲ�����ɰ�ɫ����������֤��һ����H2SO4���ڣ�
�����㾫����������Ĺؼ����������кͷ�Ӧ����Ӧ�õ����֪ʶ�������кͷ�Ӧ����������������κ�ˮ�ķ�Ӧ���Լ�����д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�����⣬�˽�ע�⣺a����ƽ b������ c�����ţ�

 ȫ�ų��100��ϵ�д�
ȫ�ų��100��ϵ�д� Ӣ�ŵ��ϵ�д�
Ӣ�ŵ��ϵ�д�