题目内容
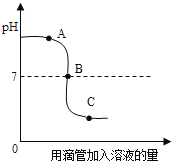
【题目】生铁是铁的合金,化学兴趣小组的同学为测定某生铁样品中铁的质量分数.进行如下实验:称取生铁样品5.8g放入烧杯中,逐滴加入稀硫酸,所加稀硫酸的质量与放出气体的质量关系如图所示(生铁样品中的杂质不与稀硫酸反应,也不溶于水).回答下列问题:
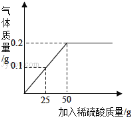
(1)当滴加稀硫酸质量为______时,反应恰好完全,此时产生气体质量是______.
(2)计算恰好反应时所得溶液中溶质的质量._____。(温馨提示:Fe+H2SO4=FeSO4+H2↑)
【答案】50g 0.2g 15.2g
【解析】
生铁是铁的合金,铁和稀硫酸反应生成硫酸亚铁和氢气,加入的稀硫酸溶液的质量为50g时,生成氢气的质量为0.2g,恰好完全反应,根据化学方程式计算溶液中溶质的质量。
(1)生铁样品中的杂质不与稀硫酸反应,也不溶于水,由图可知,铁完全反应用去的硫酸的质量是50g,产生气体质量是0.2g。
(2)设反应生成的硫酸亚铁的质量为x

![]()
x=15.2g
答:恰好反应时所得溶液中溶质的质量为15.2g。

【题目】金属材料在国民生产和日常生活中得到普遍广泛的应用
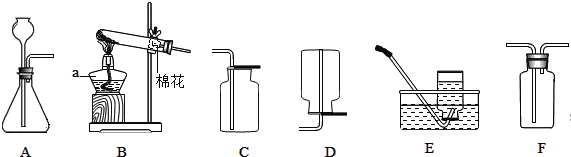
(1)用如图所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁片);
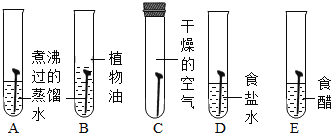
①甲同学认为,试管A发生的现象就能够说明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果。乙同学不同意他的观点,认为必须全面观察试管_______(选填试管编号)发生的现象,并经过科学严谨的推理,才能得出上述结论。B中植物油的作用是_______。
②试管D和E实验的目的是进一步探究铁在_______的环境中是否更容易锈蚀。
(2)黄铜(铜锌合金)用作弹壳的制造。现有一批使用过的,锈迹斑斑的弹壳,处理这批弹壳可以制得硫酸锌和铜,其主要流程如图甲所示:
(收集资料)弹壳上的锈主要为Cu2(OH)2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水,也不参加反应。
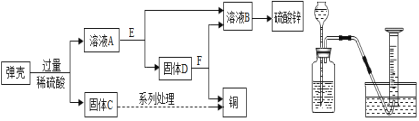
甲 乙
①写出弹壳上的锈与稀硫酸反应的化学方程式_______。
②固体D为_______。从微观的角度来看,A与E的反应微观实质是_______。
(3)为了比较甲、乙两种金属的活动性强弱和相对原子质量大小,小昊设计了一套实验装置(如图乙),他取两种金属各m克,分别加入足量的稀硫酸进行反应,在相同条件下测定不同时间内收集到的气体体积,实验记录如表:
反应时间(秒) | 20 | 40 | 60 | 80 | 100 | 120 | 140 | |
收集到的气体体积(毫升) | 甲金属 | 25 | 60 | 95 | 130 | 160 | 170 | 170 |
乙金属 | 30 | 75 | 120 | 150 | 150 | 150 | 150 | |
①由实验结果可知:金属活动性较强的是_______。实验中,除了要控制两种金属的质量相等,还需要控制的变量有_______。
②为了使得到的实验数据准确,小昊开始收集气体的时间点应该是_______(填字母)
A.导管口一有气泡冒出时 B.冒出气泡连续且均匀时C.检验产生的气体纯净时
③根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道的数据是______。