题目内容
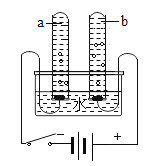
【题目】某校小组同学利用下图装置完成了有关锌和金属X的兴趣实验。实验前检查装置气密性良好,K1、K2、K3均已关闭。
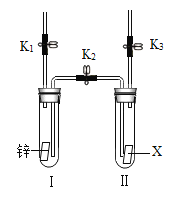
(1)打开K1,用注射器向I中注入稀硫酸,直至液面浸没下端导管口,此时发生反应的化学方程式为_____。
(2)打开_____,关闭_____,一段时间后,I中的液体转移到II中,其原因是_____。
(3)依据实验现象,所得结论正确的是_____(填字母序号)。
A 若金属X表面无明显现象,说明X一定是铜
B 若金属X表面有无色气泡产生,说明X是氢前金属
【答案】![]() K2、K3 K1 生成氢气,使装置I内压强增大 B
K2、K3 K1 生成氢气,使装置I内压强增大 B
【解析】
(1)I中金属为锌,向I中注入稀硫酸,锌与稀硫酸反应生成硫酸锌和氢气,故发生反应的化学方程式为![]() ;
;
(2)打开K2、K3,关闭K1,一段时间后,I中的液体转移到II中,因为锌与稀硫酸反应生成氢气,Ⅰ中压强增大;
(3)A、若金属表面无明显现象,说明该金属不与稀硫酸反应,在金属活动性顺序里,金属X位于氢之后,不一定是铜,不符合题意;
B、若金属表面有无色气泡产生,说明金属和稀硫酸反应生成氢气,在金属活动性顺序里,金属X位于氢前面,符合题意。
故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下图是白炽灯泡,灯丝是下列哪种金属_____。
A 铝丝 B 铁丝 C 钨丝 D 铜丝
铝、铁、钨(W)、铜是日常生活中常见的金属,某同学在实验室中比较这四种金属的活泼性,设计了如下实验流程,并进行实验。

(1)把这四种洁净的金属丝分别放入盛有盐酸的试管中,只有两支试管中有气泡产生。其中一支试管中发生反应的化学方程式为:
_____。
(2)现有铝丝和铁丝,要比较铝和铁的活泼性,还可用_____试剂。
(3)
实验 | 操作步骤 | 现象 |
实验A | 把洁净的钨丝放入硝酸铜溶液中 | 无明显现象 |
实验B | 把洁净的铜丝放入硝酸钨[W(NO3)3]溶液中 | 铜丝表面有银白色固体生成。 |
能够比较钨(W)与铜活泼性的是实验_____。归纳总结:铝、铁、钨、铜活泼性由强到弱的顺序为_____。
【题目】25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是( )
编号 | ① | ② | ③ | ④ |
水的质量/g | 50 | 50 | 50 | 50 |
加入固体质量/g | 5 | 10 | 15 | 20 |
现象 | 固体完全溶解 | 固体完全溶解 | 剩余少量固体 | 剩余少量固体 |
A.实验①所得溶液质量分数为10%
B.实验说明25℃时该物质的溶解度是20g
C.实验③④所得溶液质量分数相同
D.实验④所得溶液中含溶质20g