题目内容
【题目】一包固体粉末可能含有NaNO3、CaCO3、NaOH、FeCl3、NaCl和Ba(NO3)2中的一种或几种,为确定其组成,现做如下实验:取少量固体加足量的水溶解,过滤得沉淀Ⅰ和无色溶液Ⅰ,后续实验及现象如下图:
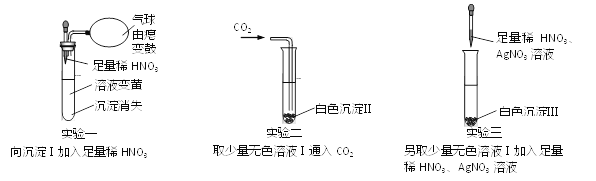
试回答:
(1)沉淀I中成分有_____________(有2种)。
(2)白色沉淀II是______,生成白色沉淀II总反应的化学方程式_________。
(3)通过上述实验,固体粉末中不能确认的物质是NaCl和_______,其中不能确认NaCl的原因是_________。
【答案】 CaCO3Fe(OH)3 BaCO3 2NaOH+CO2 +Ba(NO3)2= BaCO3↓+ H2O+ 2NaNO3 NaNO3 FeCl3含有Cl—或FeCl3与NaOH溶液反应生成NaCl
【解析】本题物质的鉴别和推断,考查了碱、盐的化学性质。根据铁离子在溶液中显黄色,碳酸钙难溶于水,但是会溶于酸,钡离子会与碳酸根离子生成的碳酸钡沉淀,银离子与氯离子生成氯化银沉淀进行分析。
(1)沉淀中加入稀硝酸溶液变黄,说明沉淀中的铁离子;加入稀硝酸后的气体产生,说明沉淀中有可能的碳酸盐,结合题意沉淀I中成分有CaCO3、Fe(OH)3;
(2)根据题意实验二中能产生沉淀的物质是Ba(NO3)2引起,结合通入CO2后产生白色沉淀,白色沉淀II是BaCO3,生成白色沉淀II总反应的化学方程式是2NaOH+CO2 +Ba(NO3)2= BaCO3↓+ H2O+ 2NaNO3;
(3) NaNO3与上述物质不能发生反应,它存在不影响实验现象;FeCl3含有Cl—(或FeCl3与NaOH溶液反应生成NaCl),通过上述实验,固体粉末中不能确认的物质是NaCl和NaNO3,其中不能确认NaCl的原因是FeCl3含有Cl—(或FeCl3与NaOH溶液反应生成NaCl)。

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图所示,下列说法不正确的是( )
物质 | 甲 | 乙 | 丙 | 丁 |
反应前物质的质量/g | 8 | 40 | 10 | 20 |
反应后物质的质量/g | 12 | 4 | X | 52 |
A. 反应中甲、乙的质量比为3:1 B. 该反应可以表示为2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
C. 该反应为分解反应 D. 丙可能为不参加反应的杂质