题目内容
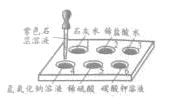
【题目】下图是氧化沉淀法生产复印用高档Fe3O4粉的部分工艺流程简图。
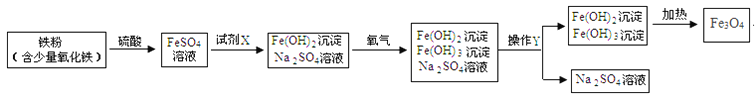
(1)试剂X是_____(写化学式)。
(2)操作Y的名称为_____,该操作需要的玻璃仪器有烧杯、玻璃棒、_____等。
(3)硫酸与氧化铁的反应的化学方程式为_____。
(4)往铁粉(含少量氧化铁)中加入硫酸,除铁、氧化铁与硫酸发生反应外,一定还发生其它反应。作出这种判断的依据是_____。
(5)通入氧气时的化学方程式是:(请补充完整)![]() ______
______![]() ,由沉淀获得Fe3O4的过程中发生的反应为
,由沉淀获得Fe3O4的过程中发生的反应为![]() ,因此,通入氧气时,必须控制“一定量”,其目的是_____。
,因此,通入氧气时,必须控制“一定量”,其目的是_____。
【答案】NaOH 过滤 漏斗 ![]() 生成物只有一种 H2O 防止氢氧化亚铁被完全氧化成氢氧化铁
生成物只有一种 H2O 防止氢氧化亚铁被完全氧化成氢氧化铁
【解析】
(1)根据硫酸亚铁转化为氢氧化亚铁和硫酸钠分析;
(2)根据混合物中沉淀和溶液分开的操作是过滤分析;
(3)根据酸与金属氧化物发生复分解反应进行书写化学方程式;
(4)根据反应物与生成物的种类分析;
(5)根据反应物的性质和反应所控制的条件分析。
(1)FeSO4与试剂1生成了Fe(OH)2和Na2SO4,所以试剂1为氢氧化钠;故答案为:NaOH;
(2)将混合物中沉淀和溶液分开的操作是过滤,该操作需要的玻璃仪器有烧杯、玻璃棒、漏斗;故答案为:过滤;漏斗;
(3)氧化铁与硫酸发生复分解反应生成硫酸铁和水,反应的化学方程式为![]() ;故答案为:
;故答案为:![]() ;
;
(4)铁、氧化铁与硫酸发生反应生成硫酸亚铁和硫酸铁,但生成物中只有硫酸亚铁,可见在里面一定还发生了我们并不知道的其它反应;故答案为:生成物只有一种;
(5)因为氢氧化亚铁与氧气、水反应生成氢氧化铁,所以化学方程式为![]() .故填:H2O ;由沉淀获得Fe3O4的过程中发生的反应为
.故填:H2O ;由沉淀获得Fe3O4的过程中发生的反应为![]() ,因此,通入氧气时,必须控制“一定量”,其目的是防止氢氧化亚铁被完全氧化成氢氧化铁;故填:防止氢氧化亚铁被完全氧化成氢氧化铁。
,因此,通入氧气时,必须控制“一定量”,其目的是防止氢氧化亚铁被完全氧化成氢氧化铁;故填:防止氢氧化亚铁被完全氧化成氢氧化铁。

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】某白色固体可能由BaC12、NaOH、Na2CO3、Na2SO4;中的一种或几种物质组成,某兴趣小组的同学为确定该白色固体的成分,进行了如下的实验探究,请你参与并回答相关问题。
I.初步探究:小金同学设计的实验过程及现象如图所示。
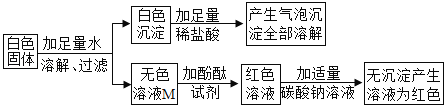
(查阅资料)BaC12溶液显中性。
(初步结沦)(1)原白色固体中一定有的物质是_____,一定没有的物质是_____。白色沉淀溶解的化学方程式是_____。
(2)M溶液中的溶质一定有_____,一定没有氯化钡。
(交流讨论)小英同学认为:无色溶液M变红色,说明溶液M中含有碱性物质,但不能由此推导出原固体物质中是否含有氢氧化钠。若要进一步确定,需对溶液M继续进行探究。为此同学们进行了如下的探究:
Ⅱ.继续探究:
(提出问题)无色溶液M中有氢氧化钠吗?
(猜想与假设)猜想一:有NaOH
猜想二:没有NaOH
(探究与结论)
实验步骤 | 实验现象 | 实验结论 |
A.取无色溶液M于试管中,加入过量的氯化钡溶液,振荡,静置 | _____ | 证明溶液M中有碳酸钠并被除尽 |
B.取实验A所得上层清液于试管中,加入_____。 | _____ | 猜想一正确 |
在老师的指导下,同学们通过交流、讨论、实验,圆满地完成了这次探究活动。