题目内容
 某中学综合实践活动小组在进行“诚信商品”研究时,检验商品标签所列成分及含量与实际是否相符.随机取出市售某种“纯碱”样品(成分说明见图),经检验杂质仅是氯化钠.准确称取样品10.9克,加入足量的氯化钙溶液使其完全反应,其反应式:Na2CO3+CaCl2=2NaCl+CaCO3↓.将反应生成的沉淀物经过滤,洗涤,烘干,干燥后得到白色固体l0克.试通过计算确定该纯碱是否可以列入“诚信商品”.
某中学综合实践活动小组在进行“诚信商品”研究时,检验商品标签所列成分及含量与实际是否相符.随机取出市售某种“纯碱”样品(成分说明见图),经检验杂质仅是氯化钠.准确称取样品10.9克,加入足量的氯化钙溶液使其完全反应,其反应式:Na2CO3+CaCl2=2NaCl+CaCO3↓.将反应生成的沉淀物经过滤,洗涤,烘干,干燥后得到白色固体l0克.试通过计算确定该纯碱是否可以列入“诚信商品”.
解:碳酸钠和氯化钙反应生成碳酸钙和氯化钠,碳酸钙不溶于水,氯化钠溶于水,所以经过过滤,洗涤,烘干的白色固体是碳酸钙,即碳酸钙的质量是10g,设生成10克碳酸钙需要碳酸钠的质量为X.
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 100
X 10g
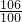 ═
═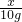
∴X=10.6g
∴样品中氯化钠的质量=10.9g-10.6g=0.3g;样品中氯化钠的质量分数=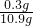 ×100%═2.75%<5%.
×100%═2.75%<5%.
∴该纯碱可以列入“诚信商品”.
分析:写出化学方程式并代入数据计算出碳酸钠的质量,然后算出样品中氯化钠的质量分数并和包装上的含量进行比较即可.
点评:这个题比较新颖,关键是能够判断白色固体是碳酸钙,计算时注意规范性.
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 100
X 10g
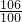 ═
═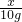
∴X=10.6g
∴样品中氯化钠的质量=10.9g-10.6g=0.3g;样品中氯化钠的质量分数=
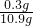 ×100%═2.75%<5%.
×100%═2.75%<5%.∴该纯碱可以列入“诚信商品”.
分析:写出化学方程式并代入数据计算出碳酸钠的质量,然后算出样品中氯化钠的质量分数并和包装上的含量进行比较即可.
点评:这个题比较新颖,关键是能够判断白色固体是碳酸钙,计算时注意规范性.

练习册系列答案
相关题目
 某中学综合实践活动小组在进行“诚信商品”研究时,检验商品标签所列成分及含量与实际是否相符.随机取出市售某种“纯碱”样品(成分说明见图),经检验杂质仅是氯化钠.准确称取样品10.9克,加入足量的氯化钙溶液使其完全反应,其反应式:Na2CO3+CaCl2=2NaCl+CaCO3↓.将反应生成的沉淀物经过滤,洗涤,烘干,干燥后得到白色固体l0克.试通过计算确定该纯碱是否可以列入“诚信商品”.
某中学综合实践活动小组在进行“诚信商品”研究时,检验商品标签所列成分及含量与实际是否相符.随机取出市售某种“纯碱”样品(成分说明见图),经检验杂质仅是氯化钠.准确称取样品10.9克,加入足量的氯化钙溶液使其完全反应,其反应式:Na2CO3+CaCl2=2NaCl+CaCO3↓.将反应生成的沉淀物经过滤,洗涤,烘干,干燥后得到白色固体l0克.试通过计算确定该纯碱是否可以列入“诚信商品”. (2006?庐阳区一模)某中学综合实践活动小组在进行“诚信商品”研究时,检验商品标签所列成分及含量与实际是否相符?随机取出市售某种“纯碱”样品(成分说明见图),经检验杂质仅是氯化钠?准确称取样品10.9克,加入足量的氯化钙溶液使其完全反应,其反应式:Na2CO3+CaCl2=2NaCl+CaCO3↓?将反应生成的沉淀物经过滤,洗涤,烘干,干燥后得到白色固体10克?
(2006?庐阳区一模)某中学综合实践活动小组在进行“诚信商品”研究时,检验商品标签所列成分及含量与实际是否相符?随机取出市售某种“纯碱”样品(成分说明见图),经检验杂质仅是氯化钠?准确称取样品10.9克,加入足量的氯化钙溶液使其完全反应,其反应式:Na2CO3+CaCl2=2NaCl+CaCO3↓?将反应生成的沉淀物经过滤,洗涤,烘干,干燥后得到白色固体10克? 某中学综合实践活动小组在进行“诚信商品”研究时,检验商品标签所列成分及含量与实际是否相符.随机取出市售某种“纯碱”样品(成分说明见图),经检验杂质仅是氯化钠.准确称取5.5g该样品,加入足量的氯化钙溶液使其完全反应,其反应式为:Na2CO3+CaCl2═CaCO3↓+2NaCl.将反应生成的沉淀物经过滤、洗涤、烘干、干燥后得到白色固体5g.
某中学综合实践活动小组在进行“诚信商品”研究时,检验商品标签所列成分及含量与实际是否相符.随机取出市售某种“纯碱”样品(成分说明见图),经检验杂质仅是氯化钠.准确称取5.5g该样品,加入足量的氯化钙溶液使其完全反应,其反应式为:Na2CO3+CaCl2═CaCO3↓+2NaCl.将反应生成的沉淀物经过滤、洗涤、烘干、干燥后得到白色固体5g. (2006?平谷区二模)某中学综合实践活动小组在进行“诚信商品”研究时,检验商品签所列成分及含量与实际是否相符.随机取出市售某种“纯碱”样品(成分说明见图),经检验杂质仅是氯化钠.准确称取样品10.9克,加入足量的氯化钙溶液使其完全反应.将反应生成的沉淀物经过滤,洗涤,烘干,干燥后得到白色固体10克.试通过计算判断此纯碱是否可列入“诚信商品”.
(2006?平谷区二模)某中学综合实践活动小组在进行“诚信商品”研究时,检验商品签所列成分及含量与实际是否相符.随机取出市售某种“纯碱”样品(成分说明见图),经检验杂质仅是氯化钠.准确称取样品10.9克,加入足量的氯化钙溶液使其完全反应.将反应生成的沉淀物经过滤,洗涤,烘干,干燥后得到白色固体10克.试通过计算判断此纯碱是否可列入“诚信商品”.