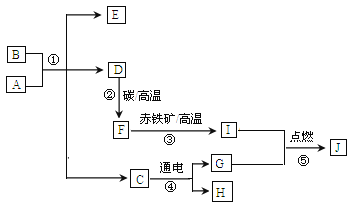
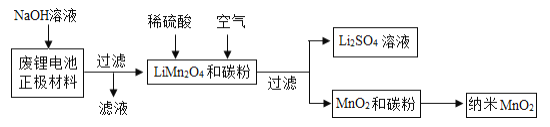
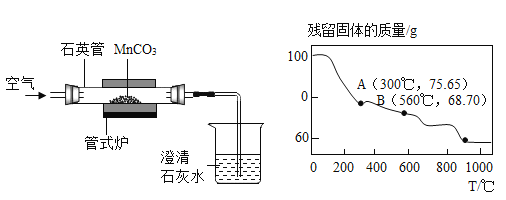
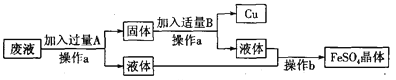
题目内容
【题目】某课外活动小组为了测定一批石灰石中碳酸钙的质量分数,将石灰石样品研成粉末,然后取一定量的石灰石粉末与过量稀盐酸充分反应(假设石灰石中的杂质既不和酸反应,也不溶于水)。过滤、洗涤、干燥后称量滤渣质量的数据见下表:

(1)该样品中碳酸钙的质量分数的平均值为_______(结果精确到0.1%)。
(2)引起三次实验数据差异的操作原因可能是______________。
【答案】 90.0% 未充分过滤
【解析】解:(1)石灰石粉末与过量稀盐酸充分反应(假设石灰石中的杂质既不和酸反应,也不溶于水)。所以每次实验中减少的固体质量即为碳酸钙的质量。样品中碳酸钙的质量分数的平均值为
3.4g-0.3g+3.6g-0.4g+5.0g-0.5g |
3.4g+3.6g+5.0g |
×100%=90.0%
(2)引起三次实验数据差异的操作原因可能是:石灰石中碳酸钙分布不均匀(或滤渣未清洗干净或称量样品不准确或称量滤渣不准确或石灰石颗粒未充分反应)。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 | 剩余固体的质量 |
第一次加入10g | 3.0g |
第二次加入10g | 2.0g |
第三次加入10g | 1.0g |
第四次加入10g | 0.6g |
请计算:
(1)4.0g石灰石样品中碳酸钙的质量是____g。
(2)10g稀盐酸能与_____g碳酸钙正好完全反应。
(3)求稀盐酸的溶质质量分数为_________(写出计算过程,结果精确到0.1%)