题目内容
【题目】甲、乙、丙、X、Y、Z六种初中常见的物质,甲、乙、丙含有相同的金属元素,甲常作为补钙剂;X的固体常用于人工降雨,Y、Z都显碱性,但不属于同类别物质,Z俗称为纯碱。(“﹣”表示物质之间发生反应,“→”表示物质之间能一步转化)回答下列问题:
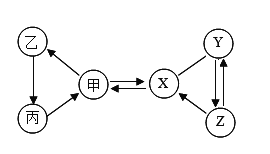
(1)Z的化学式为_____。
(2)写出乙→丙反应的化学方程式:_____,反应类型为_____(填基本反应类型),该反应过程中_____(填“放热”或“吸热”)
(3)①写出X+Y反应的化学方程式:_____。②写出Z→Y的反应的化学方程式:_____。
【答案】Na2CO3 CaO+H2O=Ca(OH)2 化合反应 放热 CO2+2NaOH=Na2CO3+H2O Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
【解析】
(1)甲、乙、丙、X、Y、Z六种初中常见的物质,甲、乙、丙含有相同的金属元素,甲常作为补钙剂,所以甲是碳酸钙,X的固体常用于人工降雨,所以X是二氧化碳,Y、Z都显碱性,但不属于同类别物质,Z俗称为纯碱,所以Z是碳酸钠,Y与碳酸钠可以互相转化,所以Y是氢氧化钠,碳酸钙在高温的条件下生成氧化钙和二氧化碳,所以乙是氧化钙,氧化钙和水反应生成氢氧化钙,所以丙是氢氧化钙,经过验证,推导正确,所以Z的化学式为Na2CO3;
(2)乙→丙的反应是氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2,反应类型为化合反应,该反应过程中放热;
(3)①X+Y的反应是二氧化碳和氢氧化钠反应生成碳酸钠和水,化学方程式为:CO2+2NaOH=Na2CO3+H2O;
②Z→Y的反应是碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
故答案为:(1)Na2CO3;(2)CaO+H2O=Ca(OH)2,化合反应,放热;(3)①CO2+2NaOH=Na2CO3+H2O;②Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。

 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】某小组进行了如下实验,请回答下列问题。
序号 | 甲 | 乙 | 丙 |
实验 |
|
|
a、c为干燥的紫色石蕊试纸 b、d为湿润的紫色石蕊试纸 |
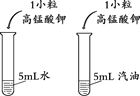
(1)甲实验的目的是________。
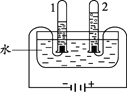
(2)乙实验,若电解18g 水,则试管2内得到的气体质量为_____g 。
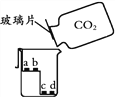
(3)丙实验,说明二氧化碳密度大于空气且能与水反应的现象是________________。
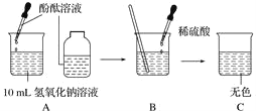
【题目】(实验回顾)在烧杯中加入约 5mL 稀氢氧化钠溶液,滴入几滴酚酞溶液。用滴 管慢慢滴入稀盐酸,并不断搅拌。
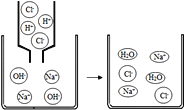
(1)该实验证明了盐酸和 NaOH 溶液能发生化学反应,依据的现象是_____。
(2)反应的化学方程式为_____。
(探究活动 1)通过证明有水生成来证明酸和碱之间反应的发生。
(查阅资料)a.变色硅胶吸水后由蓝色变为红色;b.无水醋酸是一种酸,常温下为无色液体。
(设计实验)取变色硅胶、无水醋酸和氢氧化钠固体进行如图 1 所示的实验。
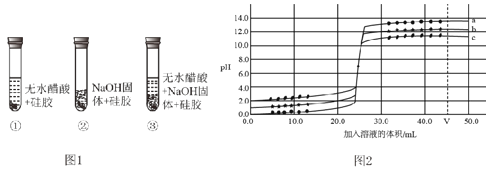
(1)加入试剂后,要迅速塞紧橡胶塞的原因是 _____。
(2)上述实验中能证明酸和碱反应有水生成的现象是_____。
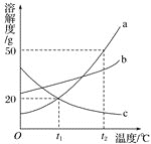
(探究活动 2)通过 pH 变化来证明酸和碱之间反应的发生。图 2 为三种不同浓度的氢氧化 钠溶液与对应浓度盐酸反应的曲线。
(1)该实验是_____(填字母)。
A 将盐酸加入氢氧化钠溶液中 B 将氢氧化钠溶液加入盐酸中
(2)三条曲线所示实验中,所用盐酸浓度最大的是_____(填“a”、“b”或“c”)。
(3)加入溶液体积为 VmL 时,所得溶液中溶质是_____(写化学式)。
(拓展延伸)某同学查阅资料得知常温下 pH 与溶液中 H+浓度有如下关系:
H+浓度(单位略) | 0.1 | 0.01 | 0.001 | 0.0001 | … |
pH | 1 | 2 | 3 | 4 | … |
(1)pH=6 时溶液中 H+的浓度为_____。
(2)下列说法正确的是_____(填字母)。
A H+浓度越大,pH 越小
B pH=1 的盐酸与 pH=3 的盐酸混合后,所得溶液 pH 为 2
C 测定盐酸的 pH 时,先将 pH 试纸用水润湿,再将待测液滴在 pH 试纸上
D 向两份相同的稀盐酸中分别加等体积的水和氢氧化钠溶液,溶液 pH 增大程度相同
(3)推测将 pH=5 的盐酸加水稀释至 1000 倍时,溶液的 pH_____(填字母)。
A 等于 6 B 等于 7 C 等于 8 D 以上都不对