题目内容
下列数据是氯化钠和氯化钾固体在不同温度时的溶解度.
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
|
溶解度/g |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
|
KCl |
27.6 |
34.0 |
40.0 |
45.5 |
51.1 |
56.7 |
(1)在0~20℃时,KCl的溶解度 (填“>”或“<”)NaCl的溶解度.
(2)20℃时,向100g水中加入25g氯化钠,充分溶解后,得到的溶液为 (填“饱和”或“不饱和”)溶液,溶液中溶质质量分数为 .
(3)20℃时,进行了如下图所示的实验.
20℃100g水加KCl20g升温至40℃升温至100℃A B 加KCl20gC 加28g KCl恒温100℃D E
①A~E中,溶液中溶质质量分数相同的是 .
②下列操作能使E溶液中溶质质量分数变小的是 (填字母序号).
a.加入2g KCl b.加入100g 100℃的水 c.降温至40℃
(1)<;(2)不饱和;20%;(3)①CD;②bc.
【解析】
试题分析:(1)由表中数据可知在0~20℃时,KCl的溶解度<NaCl的溶解度;(2)20℃时氯化钠的溶解度是36g,所以100g水中最多能溶解36g氯化钠,所以20℃时,向100g水中加入25g氯化钠,充分溶解后,得到的溶液为不饱和溶液,溶液中溶质质量分数为: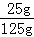 ×100%=20%;(3)①A溶液是不饱和溶液,溶质质量分数是:
×100%=20%;(3)①A溶液是不饱和溶液,溶质质量分数是: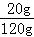 ×100%;B溶液为饱和溶液,溶质质量分数为:
×100%;B溶液为饱和溶液,溶质质量分数为: ×100%;C溶液刚好饱和,溶质质量分数为:
×100%;C溶液刚好饱和,溶质质量分数为: ×100%;D溶液不饱和,溶质质量分数为:
×100%;D溶液不饱和,溶质质量分数为: ×100%;E溶液是饱和溶液,溶质质量分数为:
×100%;E溶液是饱和溶液,溶质质量分数为: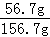 ×100%,由以上分析可知溶液中溶质质量分数相同的是CD;②使E溶液中溶质质量分数变小可能由于溶剂多了,或溶质少了造成的,E中已经饱和再加入2g KCl不能溶解,溶质质量分数不变;加入100g 100℃的水,溶质不变,溶剂多了,溶质质量分数变小;降温至40℃会析出晶体,溶质少了,溶剂不变,溶质质量分数变小.
×100%,由以上分析可知溶液中溶质质量分数相同的是CD;②使E溶液中溶质质量分数变小可能由于溶剂多了,或溶质少了造成的,E中已经饱和再加入2g KCl不能溶解,溶质质量分数不变;加入100g 100℃的水,溶质不变,溶剂多了,溶质质量分数变小;降温至40℃会析出晶体,溶质少了,溶剂不变,溶质质量分数变小.
考点:固体溶解度的影响因素;饱和溶液和不饱和溶液.

某校课外小组同学将含有泥沙和碳酸钠杂质的食盐样品进行了如下实验:向一只60 g的烧杯中加入140 g样品,然后分5次加入盐酸,每次加入盐酸70 g(不考虑水、氯化氢逸出),每次反应完全后,称量烧杯和烧杯内物质的总质量。记录实验数据如下:
| 加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 |
| 烧杯和烧杯内物质的总质量/g | 267.8 | 335.6 | 403.4 | 471.2 | 541.2 |
请回答下列问题:
(1)反应过程中产生二氧化碳的总质量为 。
(2)食盐样品中钠元素与氯元素的质量比是多少?
(3)将实验后的溶液全部转化为氯化钠溶液,还需要加入碳酸钠粉末的质量是多少?
某校课外小组同学将含有泥沙和碳酸钠杂质的食盐样品进行了如下实验:向一只60 g的烧杯中加入140 g样品,然后分5次加入盐酸,每次加入盐酸70 g(不考虑水、氯化氢逸出),每次反应完全后,称量烧杯和烧杯内物质的总质量。记录实验数据如下:
|
加入稀盐酸次数 |
1 |
2 |
3 |
4 |
5 |
|
烧杯和烧杯内物质的总质量/g |
267.8 |
335.6 |
403.4 |
471.2 |
541.2 |
第5次加酸后,烧杯底部剩余不溶固体1.8 g。已知泥沙成分为SiO2,它不溶于水,也不与盐酸发生反应。
请回答下列问题:
(1)反应过程中产生二氧化碳的总质量为 。
(2)食盐样品中钠元素与氯元素的质量比是多少?
(3)将实验后的溶液全部转化为氯化钠溶液,还需要加入碳酸钠粉末的质量是多少?
某校课外小组同学将含有泥沙和碳酸钠杂质的食盐样品进行了如下实验:向一只60g的烧杯中加入140g样品,然后分5次加入盐酸,每次加入盐酸70g(不考虑水、氯化氢逸出),每次反应完全后,称量烧杯和烧杯内物质的总质量.记录实验数据如下:
| 加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 |
| 烧杯和烧杯内物质的总质量/g | 267.8 | 335.6 | 403.4 | 471.2 | 541.2 |
请回答下列问题:
(1)反应过程中产生二氧化碳的总质量为______.
(2)食盐样品中钠元素与氯元素的质量比是多少?
(3)将实验后的溶液全部转化为氯化钠溶液,还需要加入碳酸钠粉末的质量是多少?
| 加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 |
| 烧杯和烧杯内物质的总质量/g | 267.8 | 335.6 | 403.4 | 471.2 | 541.2 |
请回答下列问题:
(1)反应过程中产生二氧化碳的总质量为______.
(2)食盐样品中钠元素与氯元素的质量比是多少?
(3)将实验后的溶液全部转化为氯化钠溶液,还需要加入碳酸钠粉末的质量是多少?