��Ŀ����
����Ŀ����9�֣�ͬѧ�Ƕ�Na2CO3��ҺҲ��ʹ��̪��Һ�����������Ȥ������һͬ�������µ�ʵ��̽����
��������⡿����Һʹ��̪��Һ��죬����Ϊ����ˮ�н����OH����Na2CO3���� ��ѡ��ᡱ����������Ρ�������ôNa2CO3��Һ�о�������������ʹ��̪��Һ����أ�
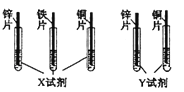
������ʵ�顿ͬѧ��ȡ�����ݷ�̪��Һ������ͼʵ��
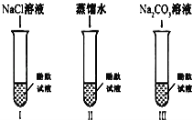
��1��ʵ��I��Ŀ����Ϊ���� ����
��2��ʵ������������ˮ��Ŀ����̽��ˮ�����Ƿ���ʹ��̪��Һ��죬С��ͬѧ��Ϊʵ����û��Ҫ��������ΪС������������ ����
��3��ʵ��������Na2CO3��Һ������̪��Һ��죬��������Һ���ٵμӹ�����CaCl2��Һ������ɫ����ʧ��ͬʱ�۲쵽������ ����
���ó����ۡ���Һ�е�CO32��ʹ��̪��Һ��죻
��������˼����4����ʦ����ͬѧ�ǵ�̽������˵����Na2CO3��Һʹ��̪���Ҳ��������Һ�д���OH����������ΪNa2CO3��Һ�д���OH����ԭ��������� ����
����չӦ�á�ͬѧ����ȡ10g�������ֻ���Ȼ��ƣ����壬�������50gϡ�����У�ǡ����ȫ��Ӧ��ʹ����ȫ���ų�������CO2��ˮ�е��ܽ⣩���õ��Ȼ�����Һ56.7g������㣺����Ӧ�в�����CO2����������������Na2CO3������������(��д���������)
���𰸡���������⡿ ��
������ʵ�顿��1��̽��Na+�ܷ�ʹ��̪��Һ��� ��2��NaCl��Һ����ˮ����
��3����ɫ���������ǣ�
��������˼����4�� CO32����Na2CO3��̼���ƣ���H2O��ˮ����Ӧ����OH��
����չӦ�á���3.3g �� 79.5%
��������
�����������������⡿Na2CO3�ɽ������Ӻ�������ӹ��ɣ�������
������ʵ�顿Na2CO3��Һ�к�����������H2O��Na+��CO32-��Ҫ̽����������������ʹ��̪��Һ�����������ͼʵ������ȡ������һ�ų�������1��ʵ��I��Ŀ����Ϊ��̽��Na+�ܷ�ʹ��̪��Һ���
��2��ʵ������������ˮ��Ŀ����̽��ˮ�����Ƿ���ʹ��̪��Һ��죬С��ͬѧ��Ϊʵ����û��Ҫ��������ΪС����������NaCl��Һ����ˮ�������̪��Һ�б�������ˮ���ӣ�������ɫ
��3��ʵ��������Na2CO3��Һ������̪��Һ��죬��������Һ���ٵμӹ�����CaCl2��Һ����������Ӧ��CaCl2+Na2CO3==CaCO3��+2NaCl��������ɫ����ʧ��ͬʱ�۲쵽������ɫ���������ǣ�
��������˼����4����ʦ����ͬѧ�ǵ�̽������˵����Na2CO3��Һʹ��̪���Ҳ��������Һ�д���OH����Na2CO3��Һ�д���OH����ԭ���������CO32����Na2CO3��̼���ƣ���H2O��ˮ����Ӧ����OH��
����չӦ�á����������غ㶨�ɣ���ѧ��Ӧǰ�����ʵ����������䣬������Ӧ�в�����CO2������=10g+50g-56.7g=3.3g���ڸ��ݻ�ѧ��Ӧ��Na2CO3+2HCl==2NaCl+H2O+CO2����Na2CO3��CO2��������ϵ���������Na2CO3�����������������������Na2CO3����������
�⣺���贿����Na2CO3������Ϊx
Na2CO3+2HCl![]() 2NaCl+CO2��+H2O
2NaCl+CO2��+H2O
106 44
x 3.3g
106:44=x��3.3g x=7.95g
Na2CO3% =7.95g/10g��100% = 79.5%
��̼���Ƶ���������Ϊ79.5%

 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�