题目内容
【题目】某工厂,高温燃烧12.5t石灰石(主要成分是CaCO3),完全反应后只生成生石灰(CaO)固体和二氧化碳气体(已知石灰石中的杂质都是固体且都不参与反应)最后得到固体质量为8.1t。试计算:
(l)CaCO3中氧元素的质量分数______。
(2)求生成二氧化碳多少______t?
(3)该工厂所用石灰石中碳酸钙的质量分数(即石灰石中CaCO3含量)是多少______?
【答案】48% 4.4 80%
【解析】
(l)CaCO3中氧元素的质量分数=![]() ;
;
(2)根据质量守恒定律可知,生成二氧化碳质量=12.5t-8.1t=4.4t;
(3)设生成4.4t的二氧化碳需碳酸钙的质量为x。

![]() x=10t;
x=10t;
该工厂所用石灰石中碳酸钙的质量分数=![]() 。
。

 新思维假期作业寒假吉林大学出版社系列答案
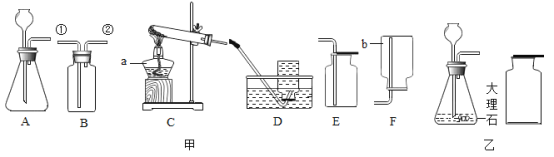
新思维假期作业寒假吉林大学出版社系列答案【题目】用如图所示装置制取气体,请回答下列问题
(1)仪器a的名称是_______。
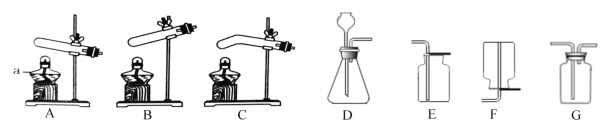
(2)小芸在实验室用氯酸钾和二氧化锰制取O2,选择的发生装置是_______(填字母,下同),该反应的化学方程式为________;小洁改用高锰酸钾来制取氧气,则发生装置应做的改动是______。
(3)实验室制取二氧化碳的化学方程式为_______,可选用的发生装置和收集装置的组合是_______,检验二氧化碳已经收集满的方法是_______。
(4)实验室在加热条件下,分解草酸晶体可以制得CO,但是加热时草酸晶体在分解之前先熔化成了液体,如果用这种方法制取CO,应选择的发生装置是_______(填字母),选择的理由是_______。
(5)兴趣小组同学利用图甲装置,用鸡蛋壳代替牙齿来探究含氟牙膏能否预防龋齿。已知:含氟牙膏(含氟成分为NaF)与鸡蛋壳发生反应,在蛋壳表而能生成氟化钙保护层。反应的化学方程式为2NaF+CaCO3 ===CaF2+Na2CO3
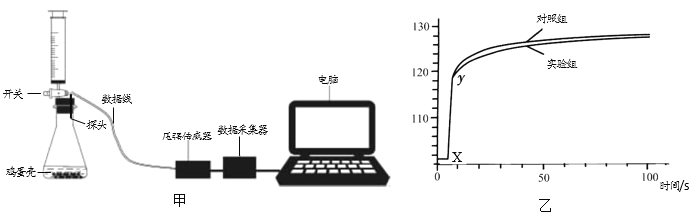
实验药品 | 实验过程 | 实验结果 | |
实验组 | 1.用牙膏处理过的鸡蛋壳0.50g 2.20mL3.5%稀盐酸 | 1.检查装置气密性; 2.将牙膏处理过的蛋壳盛放在锥形瓶,用注射器抽取20mL3.5%稀盐酸,连接好装置; 3.打开开关,将盐酸快速压入锥形瓶中; 4.关闭开关,测量100s内装置内压强的变化。 | 记录曲线图如乙所示。 |
对照组 | 1.未用牙膏处理过的鸡蛋壳0.50g 2.20mL3.5%稀盐酸 | 将“未用牙膏处理过的蛋壳”重复上述实验 | |
说明 | 1.鸡蛋壳预先用牙膏液浸泡、洗涤、晾干; 2.稀盐酸的目的是模拟形成龋齿的酸性环境。 | ||
①实验开始前,应先检查装置气密性,方法是________。
②图乙中x~y段压强增大的主要原因_________。
③根据实验数据分析,含氟牙膏能预防龋齿的理由是___________。