题目内容
【题目】氨气(NH3)的合成是人类科学技术上的重大突破。合成氨工艺的主要流程如下:
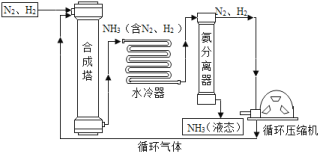
(1)合成塔中的反应必须在高温、高压并使用催化剂的条件下进行。该反应的文字表 达式为________, 该反应所属的基本反应类型是________。
(2)从合成塔排出的气体属于________(填“纯净物”或“混合物”)。
(3)在生产NH3的过程中,化合价发生改变的元素有________。
【答案】氮气+氢气![]() 氨气 化合反应 混合物 N、H
氨气 化合反应 混合物 N、H
【解析】
(1)氢气和氮气在高温、高压并使用催化剂的条件下反应生成氨气,反应的文字表达式为:氮气+氢气![]() 氨气,该反应符合多变一的特征,属于化合反应。
氨气,该反应符合多变一的特征,属于化合反应。
故填:氮气+氢气![]() 氨气;化合反应。
氨气;化合反应。
(2)从合成塔排出的气体中含有氨气、氮气、氢气,属于混合物。
故填:混合物。
(3)在生产NH3的过程中,氮元素化合价由氮气中的0变成氨气中的-3,氢元素化合价由氢气中的0变成氨气中的+1,因此化合价发生改变的元素有氮元素、氢元素。
故填:氮元素、氢元素。

 阅读快车系列答案
阅读快车系列答案【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(图1)。
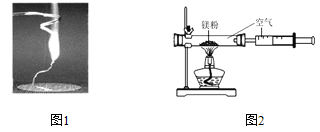
(1)镁跟氧气反应的化学方程式是_____________。
(2)小明通过称量发现:图1中石棉网上收集到产物的质量小于镁条的质量。你认为其原因可能是_______________。
(3)小红按图2装置改进实验,验证质量守恒定律,她却发现产物中还有一些黄色固体。
(提出问题)黄色固体是什么呢?
(查阅资料)①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
(做出猜想)黄色固体为Mg3N2。
(实验探究)
实验操作 | 实验现象及结论 |
| 现象:_________。 结论:燃烧产物中含Mg3N2 |
(反思与交流)①为什么在发生化学反应前后各物质的质量总和相等?请从微观角度解释_______。
②空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释_______。
(拓展延伸)①如果用图2装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数_______(填“大于”、“小于”或“等于”) 1/5。
②2.40g镁条在某氧气和氮气的混合气中完全燃烧,所得固体质量可能是___。
A 3.33g B 4.00g C 3.28g D 3.96g
【题目】(科普阅读)
| ① 木糖醇是从植物中提取出来的一种天然甜味剂,广泛存在于各种水果、蔬菜、谷类之中 |
| ② 木糖醇为白色晶体或结晶性粉末,极易溶于水,溶解时会吸收一定热量。 |
| ③ 木糖醇在一定程度上有助于牙齿的清洁度,但是过度的食用,也有可能带来腹泻等副作用,这一点也不可忽视。 |
C5H12O5 | ④ 木糖醇是一种五碳糖醇,木糖醇的甜度与砂糖相同,但热量却只有砂糖的75%。木糖醇是人体糖类代谢的正常中间体,它的代谢不同于一般糖类,主要与氧气反应生成二氧化碳和水,放出热量,被人利用。 |
依据文章内容,回答下列问题:
(1)木糖醇的物理性质是___________________。
(2)木糖醇入口有清凉感觉的原因是________________。
(3)木糖醇在人体内发生的反应可以用文字表达式表示为(反应条件略去)__________。
【题目】我校化学老师带领学生进行制取氧气实验时,发现“小李同学不慎碰倒装满氧气的集气瓶,迅速扶起后,瓶中剩余的氧气仍能使带火星的木条复燃于是” 于是化学老师与小李等其他同学决定探究能使带火星的该种材质的木条复燃所需氧气的最少的体积分数。(假设此时空气中氮气、氧气的体积分数分别为79%、21%)
实验步骤如下:
①取5个大小相同的集气瓶,分别编号为1、2、3、4、5,并分别使集气瓶内留有占集气瓶容积10%、20%、30%、40%、50%的水(余下为空气),用玻璃片盖住,并倒扣于装有水的水槽中。
②分别用排水法向上述5个集气瓶中通入氧气,小心地把5个集气瓶内的水排尽,用玻璃片盖住瓶口,取出正立放好。
③分别将带火星的木条伸入集气瓶中,观察到的现象如下:(见下表)
编号 | 1 | 2 | 3 | 4 | 5 |
现象 | 微亮 | 亮 | 很亮 | 复燃 |
|
请回答:
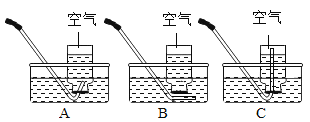
(1)用下列方案收集“50%集气瓶的氧气”,其中最合理的是________(填字母)
(2)用排水法收集气体时,如何判断集气瓶中气体已收集满?
_________________________________________________
(3)若将带火星的木条伸入编号为5的集气瓶,其现象为:_______ 。
(4)气体的体积分数是指某气体的体积与总混合气体的体积比。将带火星的木条伸入编号为4的集气瓶前,4号瓶中氧气的体积分数为_____
(5)小李认为实验到此还没有得出结论,他决定继续进行研究。为使实验更具针对性,你认为他应该使集气瓶内氧气的体积分数______(填“大于”或“小于”)4号瓶中氧气的体积分数。