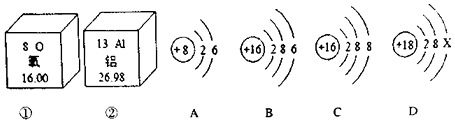
题目内容
【题目】下列对分子、原子、离子的认识,不正确的是( )
A.分子、原子、离子都能构成物质
B.温度越高,分子运动越快
C.钠原子和钠离子的化学性质不同
D.气体压缩为液体,分子体积变小
【答案】D
【解析】解:
A、分子、原子、离子都能构成物质,故正确;
B、根据分子的性质,温度越高,分子运动越快,故正确;
C、钠原子容易失去电子,而钠离子只能得到电子,钠和钠离子的化学性质不同,故正确;
D、气体压缩为液体,分子间隔变小,分子本身不变,故错误.
答案:D
A、根据构成物质的微粒解答;
B、根据分子的性质解答;
C、根据钠原子容易失去电子,而钠离子只能得到电子,钠和钠离子的化学性质不同解答;
D、根据气体压缩为液体,分子间隔变小解答.

 阅读快车系列答案
阅读快车系列答案【题目】某化学兴趣小组在实验室发现一瓶标签残缺的溶液如图1, 
(1)在老师的指导下进行如下探究: 甲同学取少量该溶液于试管中,滴加少量氯化钡溶液,发现生成了大量白色沉淀,于是他认为该溶液中的溶质是硫酸钠.
乙同学经过思考后,认为甲同学的结论不可靠,设计了如下实验:
实验操作 | 实验现象 | 实验结论 |
取甲同学的生成物,过滤,向滤渣中加入 | 白色沉淀 , 产生无色无味的气体 | 该溶液不是硫酸钠溶液,而是碳酸钠溶液 |
丙同学认为,要确认是碳酸钠,还应按图2进行改进.他取该溶液于锥形瓶中,打开分液漏斗的玻璃活塞K,滴加少量稀盐酸,结果意外发现没有冒气泡,澄清石灰水也没变浑浊.
(2)提出猜想:猜想一:盐酸放置时间过久,溶质已完全挥发 猜想二:碳酸钠变质
猜想三:当滴加的盐酸较少时,先和碳酸钠反应生成了一种新的化合物
【进行实验】(1)向该盐酸中加入少量铁粉,产生大量气泡(2)向该溶液A中滴加氯化钙溶液,产生大量沉淀
【实验小结】猜想一和猜想二都是错误的
写出实验(1)的化学方程式
(3)【讨论与交流】 丁同学认为实验(2)不必要做,原因是甲同学滴加氯化钡溶液已经证明了猜想二是错误的.
进一步探究:在老师的指导下,同学们查到如下相关资料.
【查阅资料】溶液里的复分解反应实际上是离子间的反应,碳酸钠和酸反应的过程如下
2H++CO32﹣=H2O+CO2↑,每个碳酸根离子需要结合2个氢离子才能生成CO2 , 当H+的量不够时,则发生H++CO32﹣=HCO3﹣
【进行实验】请你设计一个实验证明猜想三是否正确
实验操作 | 实验现象 | 结论 |
立即产生大量气泡 | 猜想三正确 |
【实验反思】若没有任何试剂可通过互滴法来鉴别稀盐酸和碳酸钠溶液.