题目内容
12、氢氧化钠是重要的化工原料,在保存的过程中如果密封不严容易变质.今年以来,化工原料市场供不应求,各种化工原料价格持续上扬.某化工厂为了增加效益,计划将一批库存的氢氧化钠投入市场.如果你是质检员,请你按以下方案抽取样品对该批氢氧化钠进行检验,看是否变质.
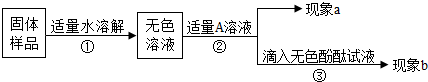
【实验方案】
【推断和结论】
(1)若现象a为有气泡产生,则加入的A溶液可能是
(2)为了进一步探究该产品变质的程度,再取少量样品,加入的A是过量的CaCl2溶液(CaCl2溶液呈中性),现象a为有白色沉淀,现象b为无色酚酞试液变红色,则证明该批产品
【反思】
久置的氢氧化钠变质的原因是(用化学方程式表示)
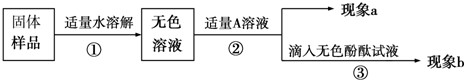
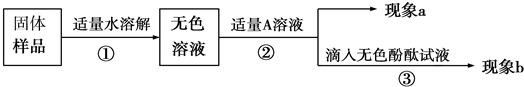
【实验方案】

【推断和结论】
(1)若现象a为有气泡产生,则加入的A溶液可能是
稀盐酸
,说明氢氧化钠已经变质.(2)为了进一步探究该产品变质的程度,再取少量样品,加入的A是过量的CaCl2溶液(CaCl2溶液呈中性),现象a为有白色沉淀,现象b为无色酚酞试液变红色,则证明该批产品
部分
(填“部分”或“完全”)变质.【反思】
久置的氢氧化钠变质的原因是(用化学方程式表示)
2NaOH+CO2=Na2CO3+H2O
.分析:(1)根据氢氧化钠的特点考虑:氢氧化钠易与空气中二氧化碳反应生成碳酸钠,加入的物质与碳酸根离子能产生气体,来考虑加入的物质;
(2)过量的CaCl2溶液与碳酸钠反应,把碳酸钠全部消耗,再考虑加入酚酞变色情况.氢氧化钠变质是与二氧化碳反应导致.
(2)过量的CaCl2溶液与碳酸钠反应,把碳酸钠全部消耗,再考虑加入酚酞变色情况.氢氧化钠变质是与二氧化碳反应导致.
解答:解:(1)氢氧化钠易与空气中二氧化碳反应生成碳酸钠,由于碳酸根遇到酸能产生气体二氧化碳,所以加入的物质是盐酸就行;
(2)氢氧化钠变质后有两种情况:全变质,部分变质,全变质就是全部为碳酸钠,部分变质是既有氢氧化钠也有碳酸钠,过量的CaCl2溶液把碳酸钠全部反应掉,再加入酚酞变红,说明显碱性溶液中含有氢氧化钠,所以部分变质.氢氧化钠变质是与二氧化碳反应,生成碳酸钠和水,直接已经平了.
故答案为:(1)稀盐酸(2)部分 化学方程式:2NaOH+CO2=Na2CO3+H2O
(2)氢氧化钠变质后有两种情况:全变质,部分变质,全变质就是全部为碳酸钠,部分变质是既有氢氧化钠也有碳酸钠,过量的CaCl2溶液把碳酸钠全部反应掉,再加入酚酞变红,说明显碱性溶液中含有氢氧化钠,所以部分变质.氢氧化钠变质是与二氧化碳反应,生成碳酸钠和水,直接已经平了.
故答案为:(1)稀盐酸(2)部分 化学方程式:2NaOH+CO2=Na2CO3+H2O
点评:解答本题要注意变质后的溶液不能直接用酚酞溶液来判断,因为变质后的碳酸钠也显碱性.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目