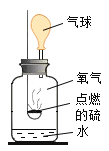
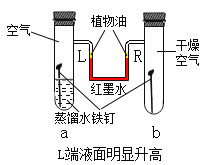
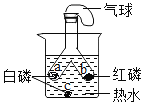
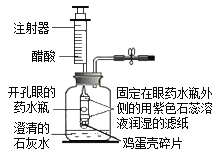
题目内容
【题目】黄铜是铜和锌合金.某化学兴趣小组的同学在测定黄铜样品中铜的含量时,取黄铜样品20g放入烧杯中,向其中加入100g稀硫酸,恰好完全反应反应后烧杯中剩余物的总质量为119. 8g.请计算:
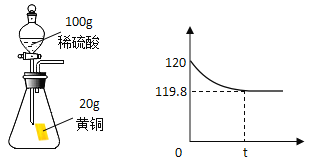
(1)反应产生氢气的质量是_____g。
(2)求黄铜样品中铜的质量分数。(写出计算过程)______
【答案】0.2 解:设黄铜样品中锌的质量为x,

![]()
x=6.5g
铜的质量分数为:![]()
答:样品中铜的质量分数为67.5%。
【解析】
根据黄铜的成分中铜和锌的性质可知,加入稀硫酸时,只有锌与硫酸反应生成了硫酸锌和氢气;根据质量守恒定律,烧杯内减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应的锌的质量,进而计算出铜的质量和铜的质量分数。
(1)根据质量守恒定律,产生氢气的质量为:20g+100g-119.8g=0.2g。故答案为:0.2
(2)设黄铜样品中锌的质量为x,
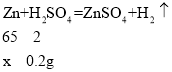
![]()
x=6.5g
铜的质量分数为:![]()
答:样品中铜的质量分数为67.5%。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
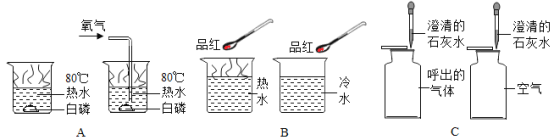
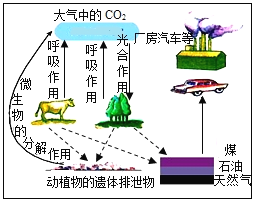
暑假接力赛新疆青少年出版社系列答案【题目】分类、类比和迁移是学习和研究化学常用的方法。
(1)化学实验改进或创新的目的主要是使实验变得更加“简化”(减少实验步骤)、“节约药品”或“环保”等。据此可将下列实验中的_____(填字母)归为一类,依据是_____。
硫在氧气中燃烧 | 铁锈蚀条件的探究 | 燃烧条件的探究 | 二氧化碳的性质 |
|
|
|
|
A | B | C | D |
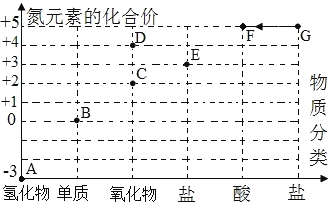
(2)下图是氮元素的价态图。氮元素显示F、G点的+5价与氮原子的_____有关。显示不同或相同化合价的含氮元素的物质可通过化学反应实现转化,G→F的化学方程式是_____。氮、磷元素位于周期表的同一纵列,仿照A点氢化物写出磷元素显示此点化合价时形成氢化物的化学式_____。
【题目】兴趣小组用如下装置,进行有关碳及其氧化物的化学性质研究(图中夹持仪器已略)。

实验目的 | 实验现象 | 实验分析 |
①连接装置AD,探究碳的化学性质。 | A中固体逐渐减少。 | A中化学方程式_____, D中酒精灯的作用_____。 |
②连接装置ABCEF,探究一氧化碳的化学性质。 | B中现象_____。 E中现象_____。 | B中化学方程式_____, C的作用_____, E的作用_____。 |