��Ŀ����
����Ŀ��ij��ȤС��ͬѧ��NaOH��Na2CO3��NaHCO3��NaCl�ȳ������ƵĻ�����������о���
��1����֪ʶ�عˡ��������˵����ȷ������
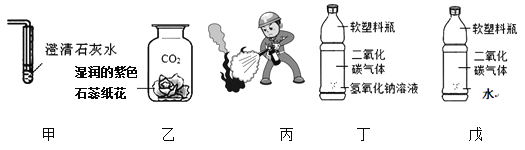
A.���������������ռ�����ڸ�����������
B.̼�����׳ƴ�����ڼ�
C.̼�������׳��մ���������θ�����
D.�Ȼ�������Ȼ������Ҫ�����ں�ˮ��
��2����������⡿NaOH¶���ڿ������ױ��ʣ���ôʵ�����е�����������û�б����أ���С��ͬѧ��ʵ������һƿ�������ƹ�����Ʒ�ijɷֽ�����̽����
���������ϡ���NaOH�ڿ����в���ת����NaHCO3��
��BaCl2��Һ�����ԣ�Ba(OH)2�ǿ����Լ
��CO2�ڱ��͵�NaHCO3��Һ�м������ܽ⡣
��������롿����٣���Ʒ��ֻ��NaOH
����ڣ���Ʒ��ֻ��Na2CO3
����ۣ���Ʒ�м���NaOH����Na2CO3
NaOH���ʷ�Ӧ�Ļ�ѧ����ʽΪ��
��3����ʵ��̽������ȤС��ͬѧ�������ʵ�����̽����
ʵ����� | ʵ����������� |
��ȡ������Ʒ��������ˮ�� | ��Ʒȫ���ܽ⣬����ɫ��Һ�� |
��.ȡ����ʵ���������ɫ��Һ���Թ��У��μ�����ϡ���ᡣ | �����ݲ��������������١������ڡ��ۡ����������� |
��.ȡ����ʵ���������ɫ��Һ���Թ��У��μ� ��Һ�� | �а�ɫ�����������йػ�ѧ����ʽΪ�� |
��.����һ��ʱ���ȡʵ��3���Թ����ϲ���Һ���μ��� | ��Ӧ���� �������۳����� |
��4���������о���������Ʒ���ʵij̶�����أ�����ȤС��ͬѧ�����ͼװ�òⶨ��Ʒ��Na2CO3������������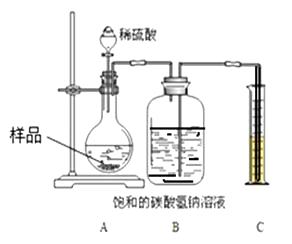
�������£�
�ٰ�ͼ���Ӻ�װ�ã�����������ԣ�
��ȷ��ȡ����Ʒ1.0g��������ƿ�ڣ�
�۴�Һ©���������μ�30.0%��ϡ�������������رջ�����
�ܷ�Ӧ��������Ͳ��Һ��Ķ���Ϊ55.0mL������֪�����������£�CO2���ܶ�Ϊ1.6gL��1��
Bװ�ü���ƿ��ԭ�еĿ�����ʵ��������С���û�С���Ӱ�졣
��5��B�м���ƿʢװ�ı��͵�̼��������Һ������ˮ���棬����������
��6����ַ�Ӧ��װ��A�в����Ķ�����̼��ʵ�����Ƿ�������Ӱ�죿����С���û�С���
��7���������Ʒ��Na2CO3������������д��������̣����������0.1%����
���𰸡�
��1��D
��2��2NaOH+CO2=Na2CO3+H2O
��3����,BaCl2,BaCl2+Na2CO3=BaCO3��+2NaCl��CaCl2Ҳ�ɣ�,��ɫ��̪,��Һ���
��4��û��
��5��������̼����ˮ
��6��û��
��7��21.2%
���������⣺��֪ʶ�عˡ�A�����������������ռ�������ڸ�����������������B��̼�����׳ƴ�������Σ�����C��̼�������׳�С�մ���������θ����࣬����D���Ȼ�������Ȼ������Ҫ�����ں�ˮ�У���ȷ�����Դ��ǣ�D�� ��������롿NaOH��������еĶ�����̼��Ӧ�����ʷ�Ӧ�Ļ�ѧ����ʽΪ2NaOH+CO2=Na2CO3+H2O����ʵ��̽�����μ�����ϡ���ᣬ�����ݲ�����˵������̼���ƣ��ʲ���ٲ���������ѡ�Լ�����̼������Һ��Ӧ���ɰ�ɫ�������ҷ�Ӧ����Һ�����ԣ��ʵμ� BaCl2 ��Һ����Ӧ����ʽΪ��BaCl2+Na2CO3=BaCO3��+2NaCl������������Һ��ʹ��̪��Һ��죬�ʵμӷ�̪��
�������о�����4��Bװ�ü���ƿ��ԭ�еĿ�����ʵ������Ӱ�졣��5��CO2�ڱ��͵�NaHCO3��Һ�м������ܽ⣬��������̼����ˮ����6����ַ�Ӧ��װ��A�в����Ķ�����̼��ʵ������Ӱ�졣��7�� ���ɶ�����̼������Ϊ��0.055L��1.6gL��1=0.088g������Ʒ��Na2CO3������Ϊx��
Na2CO3+ | 2HCl= | 2NaCl+H2O+ | CO2�� |
106 | 44 | ||
x | 0.088g |
![]() =
= ![]() ���x=0.212g
���x=0.212g
����Ʒ��Na2CO3����������Ϊ�� ![]() ��100%=21.2%��
��100%=21.2%��
���Դ��ǣ���1��D����2��2NaOH+CO2=Na2CO3+H2O����3���٣�BaCl2��BaCl2+Na2CO3=BaCO3��+2NaCl����ɫ��̪����Һ��죻��4��û�У���5��������̼����ˮ����6��û�У���7��21.2%��
�����㾫����������Ҫ��������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ���ݻ�ѧ��Ӧ����ʽ�ļ�������֪ʶ�㣬��Ҫ����ע�⣺a����ƽ b������ c�����ţ������ʼ�������=ϵ������Է�������֮�Ȳ�����ȷ�����⣮

 ������ϵ�д�
������ϵ�д� �żӾ���ϵ�д�
�żӾ���ϵ�д�