题目内容
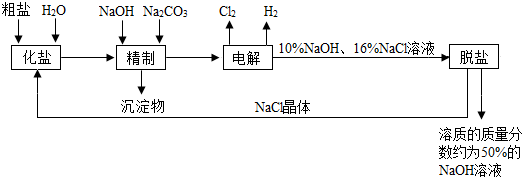
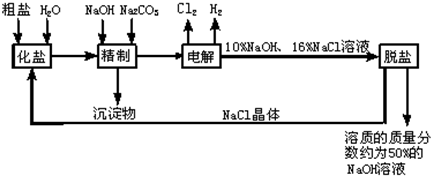
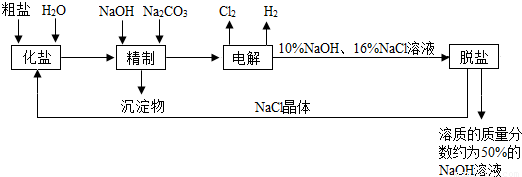
氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如下:
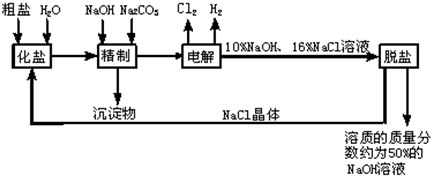
依据图,完成下列填空:
(1)粗盐中含有的较多的可溶性杂质(氯化镁、氯化钙、硫酸钠等)和
(2)工业食盐含有较多杂质,精制过程中加NaOH的作用是
(3)在电解过程中,发生反应的化学方程式为
(4)粗盐中硫酸钠含量较高,必须添加钡试剂除去硫酸根离子,该钡试剂可以是
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(5)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应,Cl2和NaOH溶液充分接触,产物是NaClO和氯化钠和水,请写出Cl2和NaOH溶液反应的化学方程式

依据图,完成下列填空:
(1)粗盐中含有的较多的可溶性杂质(氯化镁、氯化钙、硫酸钠等)和
不溶性杂质
不溶性杂质
.(2)工业食盐含有较多杂质,精制过程中加NaOH的作用是
除去氯化镁杂质
除去氯化镁杂质
.(3)在电解过程中,发生反应的化学方程式为
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
,电解后溶液的pH
| ||
升高
升高
.(填“升高”、“不变”、“降低”)(4)粗盐中硫酸钠含量较高,必须添加钡试剂除去硫酸根离子,该钡试剂可以是
A、C
A、C
.A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(5)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应,Cl2和NaOH溶液充分接触,产物是NaClO和氯化钠和水,请写出Cl2和NaOH溶液反应的化学方程式
2NaOH+Cl2═NaClO+NaCl+H2O
2NaOH+Cl2═NaClO+NaCl+H2O
.分析:(1)可根据粗盐的成分进行解答.
(2)加入氢氧化钠主要是除去镁离子.
(3)根据图可看出电解氯化钠溶液的生成物,结合质量守恒定律定律配平即可.根据生成物的性质分析溶液pH的变化.(4)除杂的要求一般所加试剂最好是不引进新的杂质离子.
(5)根据题中所给反应物和生成物,配平即可.
(2)加入氢氧化钠主要是除去镁离子.
(3)根据图可看出电解氯化钠溶液的生成物,结合质量守恒定律定律配平即可.根据生成物的性质分析溶液pH的变化.(4)除杂的要求一般所加试剂最好是不引进新的杂质离子.
(5)根据题中所给反应物和生成物,配平即可.
解答:解:(1)粗盐来源于海水,还含有泥沙等不溶性杂质.
(2)加入氢氧化钠主要是除去氯化镁,发生的反应为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
故答案为:除去氯化镁(镁离子).
(3)由图可看出电解氯化钠溶液的生成物有氯气、氢气和氢氧化钠,配平方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑因为有强碱氢氧化钠生成,所以电解后溶液的pH升高.
(4)如选用B选项的Ba(NO3)2,会引入硝酸根,很难除去,所以B选项不正确.故选AC.
(5)题中给出了反应物为Cl2和NaOH,产物是NaClO和氯化钠和水,根据质量守恒定律配平即可.
故答案为:2NaOH+Cl2═NaClO+NaCl+H2O.
(2)加入氢氧化钠主要是除去氯化镁,发生的反应为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
故答案为:除去氯化镁(镁离子).
(3)由图可看出电解氯化钠溶液的生成物有氯气、氢气和氢氧化钠,配平方程式为2NaCl+2H2O
| ||
(4)如选用B选项的Ba(NO3)2,会引入硝酸根,很难除去,所以B选项不正确.故选AC.
(5)题中给出了反应物为Cl2和NaOH,产物是NaClO和氯化钠和水,根据质量守恒定律配平即可.
故答案为:2NaOH+Cl2═NaClO+NaCl+H2O.
点评:本题是一道综合性试题,涉及知识点比较多,要求学生有完整的知识结构和分析问题的能力.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
相关题目