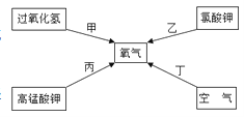
题目内容
【题目】化学是一门以实验为基础的科学。请结合下列装置图回答问题:
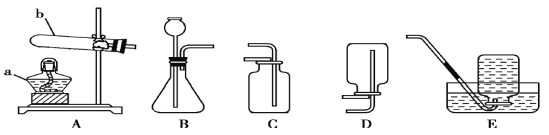
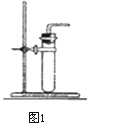
(1)装置A中标号b仪器的名称:_________。
(2)实验室用高锰酸钾制取氧气,应选择的发生装置是_________(填字母),反应的化学方程式是________。
(3)实验室中一般用锌粒和稀硫酸在常温下制取氢气
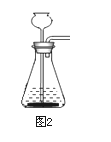
①制取氢气应选择的收集装置是_________(填字母)。
②用一定质量的金属锌与50克一定质量分数的稀硫酸恰好完全反应,实测收集到氢气的质量是0.2克,实际消耗金属锌的质量是_____(填写:大于、等于或小于)6.5克。 在反应的过程中溶液质量的变化趋势是______。
③根据化学方程式的计算,设所用硫酸的质量为X,列出计算X的比例式__________。
【答案】试管A2KMnO4![]() K2MnO4+MnO2+O2↑D或E大于先增大后不变98:2=X:0.2g
K2MnO4+MnO2+O2↑D或E大于先增大后不变98:2=X:0.2g
【解析】
(1)b仪器名称为试管;
(2)高锰酸钾制取氧气反应条件为加热,故发生装置要有加热装置,选择A装置;反应的化学方程为2KMnO4![]() K2MnO4+MnO2+O2↑,注意氧气的气体符号不要丢掉;
K2MnO4+MnO2+O2↑,注意氧气的气体符号不要丢掉;
(3)①锌与稀硫酸反应生成氢气,氢气的密度小于空气,难溶于水,故可采用向下排空气法或者排水法,装置采用D或者E均可;②因实际收集到的氢气质量为0.2g,故生成的氢气质量大于0.2g,故消耗锌的质量大于6.5g;锌的相对原子质量为65,氢气的相对分子质量为2,故反应结束前溶液质量增大,后不变;③物质间相对分子质量与化学计量数乘积之比等于物质间实际质量之比,故比例式为98:2=X:0.2g。

【题目】某小组同学在用过氧化氢溶液与MnO2制取氧气的过程中,发现反应的速率很慢,产生的气泡很少。为此,他们进行了如下探究:
(猜想与假设)
①速度慢、气泡少可能与过氧化氢溶液的浓度有关。
②速度慢、气泡少可能与MnO2的质量有关。
(进行实验)
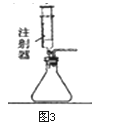
根据图甲进行如下实验。
实验1:用26mg MnO2与5mL不同浓度过氧化氢溶液进行实验,压强变化如乙图1。
实验2:用5mL 1.5%过氧化氢溶液与不同质量MnO2进行实验,压强变化如乙图2。
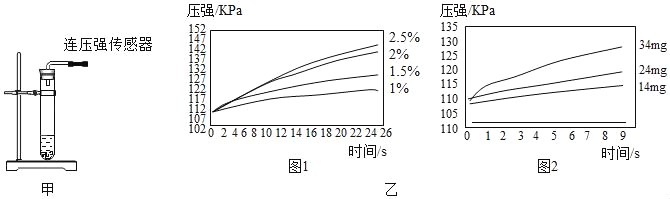
(解释与结论)
(1)过氧化氢溶液制取氧气的化学方程式为_______________。
(2)实验1得到的结论是___________________________。实验2的目的是_________。
欲得出“MnO2对过氧化氢分解有催化作用”的结论,需要对比____________。(简要的写出实验设想)
(3)小组同学通过互联网得知:多种物质能催化过氧化氢的分解。
(实验探究)
实验证明,CuSO4溶液也能显著加快过氧化氢的分解,CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42﹣ ),稀硫酸中含有三种粒子(H2O、H+、SO42﹣ )为了进一步探究CuSO4,溶液中哪种粒子能起催化作用,小组同学作了以下分析和设计。
①小组同学认为最不可能的是H2O,他们的理由是____________。
②要说明另外的两种粒子是否起到催化作用,小组同学设计了如下实验,完成探究活动。
实验步骤 | 实验现象 | 结论 |
a 取一支试管加入5mL 5%过氧化氢溶液,然后加入2﹣3滴稀硫酸 | 溶液几乎没有 气泡放出 | 验证明,起催化作用的是______。 |
b.另取一支试管加入5mL 5%过氧化氢溶液,然后加入2﹣3滴硫酸铜溶液 | 溶液中有大量气泡放出 |
(反思与评价)
(4)小组同学在进行实验1和2制取氧气过程中,发现反应的速度很慢,产生的气泡很少的原因可能是__________、_________。
(5)利用图甲装置探究“温度对过氧化氢分解速率”的影响,是否合理?_____。理由是________。