题目内容
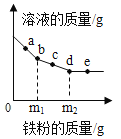
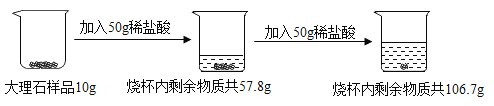
【题目】向10g大理石样品(杂质不溶于水,也不与盐酸反应)分两次加入一定溶质质量分数的稀盐酸,充分反应后烧杯内物质总质量变化如图所示。
(1)充分反应后共产生气体的总质量是 g。
(2)该大理石样品中碳酸钙的质量分数是 。
(3)计算所用稀盐酸的溶质质量分数(写出计算步骤)
【答案】(1)3.3g(2)75%(3)7.3%
【解析】
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳。
(1)由质量守恒定律可知,参加反应的反应物的总质量等于生成物的总质量,减少为生成的气体的质量,故生成的二氧化碳的质量是![]()
(2)设大理石样品中碳酸钙的质量分数是x
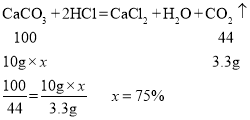
故大理石样品中碳酸钙的质量分数是75%。
(3)由于加入第一个50g稀盐酸产生的二氧化碳质量为10g+50g-57.8g=2.2g,所以生成3.3g二氧化碳时消耗的盐酸的质量为75g,设所用稀盐酸的溶质质量分数为y
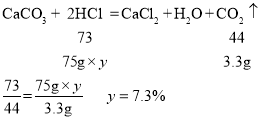
故所用稀盐酸的溶质质量分数为7.3%。

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目