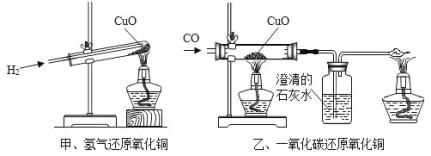
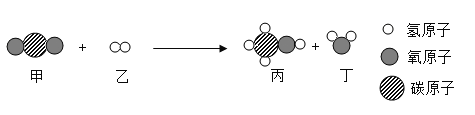
题目内容
【题目】钙元素是一种重要的金属元素,它可组成氯化钙、氢氧化钙等多种物质。
(1)氢化钙(CaH2)固体是登山运动员常用的能源提供剂。某实验探究小组的同学通过查阅资料得知,氢化钙在常温下能与水反应生产氢氧化钙和氢气,请你写出该反应的化学方程式______。
(2)该实验探究小组将Na2CO3溶液滴加到Ca(OH)2溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
(提出问题)
滤液中溶质的成分是什么?
(猜想与假设)
猜想一:NaOH
猜想二:NaOH和Ca(OH)2
猜想三:NaOH和______;
猜想四:NaOH、Na2CO3和Ca(OH)2
经过讨论,大家认为猜想四不合理,原因是______。
[实验过程]
实验步骤 | 现象 | 结论 |
步骤I:取滤液,向其中滴入适量Na2CO3溶液 | ______ | 猜想二不成立 |
步骤II:另取滤液,向其中加入足量______溶液 | 产生气泡 | 猜想______成立 |
(拓展延伸)
在分析反应后所得物质的成分时,除考虑生成物外,还需考虑______。
【答案】CaH2+2H2O=Ca(OH)2+2H2↑ Na2CO3 Na2CO3和Ca(OH)2不能共存 无明显现象 盐酸 三 反应物是否过量
【解析】
化学方程式的书写,结合题目中的信息找出反应物、生成物和反应条件,利用质量守恒定律配平,最后检查气体或沉淀符号的标注;分析探究反应后所得物质成分时,除了考虑生成物之外,还应考虑反应物本身是否过量。
(1)、由题意可知氢化钙(CaH2)在常温下和水反应生成氢氧化钙和氢气,化学方程式为:![]() ;
;
(2)、[猜想与假设]
滤液中溶质的成分可能有如下几种情况:
①Na2CO3和Ca(OH)2恰好完全反应,滤液中的溶质是NaOH;
②当Na2CO3过量时,滤液中的溶质是:Na2CO3和NaOH;
③当氢氧化钙过量时,滤液中的溶质是:Ca(OH)2和NaOH;
经过讨论,大家认为猜想四不合理,原因是Na2CO3和Ca(OH)2不能共存;
[实验过程]
步骤I:因为猜想二不成立,滤液中没有氢氧化钙,取滤液,向其中滴入适量Na2CO3溶液,无明显现象;
步骤II:因为现象是有气泡产生,另取滤液,向其中加入足量的盐酸,根据现象可知滤液中含有Na2CO3和NaOH;
[拓展延伸]
在分析反应后所得物质的成分时,除考虑生成物外,还需考虑反应物是否过量。

【题目】在学习盐酸的化学性质时,甲、乙两位同学分别做了稀盐酸和碳酸钠溶液反应的实验(如图1)。
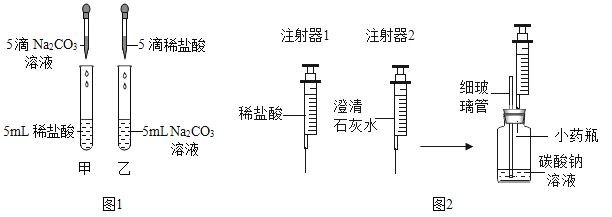
(实验现象)甲同学的实验中溶液有气泡冒出,乙同学的实验中溶液无气泡冒出。
(1)写出甲同学实验的化学反应方程式:_____________。
(提出问题)乙同学的实验中溶液为什么没有气泡冒出?
(查阅资料)碳酸钠和稀盐酸反应不仅可以生成二氧化碳还可以生成碳酸氢钠
(实验)同学们设计并进行了如图2所示的实验(装置气密性良好)。
实验编号 | 实验步骤 | 实验现象 |
① | Ⅰ.用注射器1向小药瓶中缓慢注入少量的稀盐酸,边注入边振荡 | 细玻璃管中液柱略微升高 |
Ⅱ.换注射器2从瓶中缓慢抽取气体 | 澄清石灰水无明显变化 | |
② | Ⅰ.用注射器1向小药瓶中继续注入稀盐酸至较多气泡产生 | |
Ⅱ.换注射器2从瓶中缓慢抽取气体 | 澄清石灰水变浑浊 |
(2)细玻璃管在实验中的主要作用是________;实验①中细玻璃管中液柱略微升高的原因___________。
(3)实验②中Ⅰ的现象是_________;实验①、②中步骤Ⅱ:注射器2必须缓慢地从瓶中抽取气体的原因是_________________。
(实验反思)此反应说明反应物的量不同,产物可能不同,试另举一例:____________。
(若正确回答下列问题加4分,总分不超过60分)
在老师的帮助下,同学们利用pH传感器对相同浓度的碳酸钠溶液(pH为12)、碳酸氢钠溶液(pH为8.2)与稀盐酸反应时,pH的变化与盐酸体积的关系进行了测定,并做了如下所示的对比图:
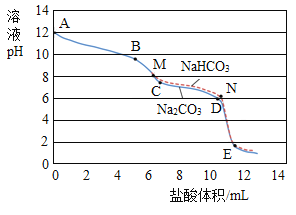
图中各线段实验现象如下表:
溶液 | 线段 | 实验现象 |
Na2CO3 | AB | 无气泡 |
BC | 有少量气泡 | |
CD | 有大量气泡 | |
DE | 几乎无气泡 | |
NaHCO3 | MN | 立即有大量气泡 |
NE | 几乎无气泡 |
(4)在AB段,溶液中的溶质有_________。
(5)分析图表,体现碳酸钠与稀盐酸反应分两步:
第一步反应:Na2CO3+HCl=NaCl+NaHCO3
第二步反应的化学方程式为:__________。