题目内容
2.4g铁和镁的混合物,与50g盐酸恰好完全反应,则该盐酸的质量分数可能是( )A.5%
B.10%
C.14%
D.15%
【答案】分析:采用极端假设法,利用铁和镁与盐酸反应的化学方程式,可计算出盐酸质量分数的取值范围,据此即可正确选择即可.
解答:解:①假设2.4g全是镁,与50g盐酸恰好完全反应,设参加反应的盐酸的质量为x,
Mg+2HCl=MgCl2+H2↑
24 73
2.4g x
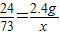 x=7.3g,
x=7.3g,
则该盐酸的质量分数为: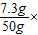 100%=14.6%;
100%=14.6%;
②假设全是Fe,与50g盐酸恰好完全反应,设参加反应的盐酸的质量为y,
Fe+2HCl=FeCl2+H2↑
56 73
2.4g y
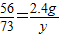 y≈3.1g,
y≈3.1g,
则该盐酸的质量分数为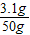 ×100%=6.2%.
×100%=6.2%.
所以盐酸质量分数应在6.2%和14.6%之间.
B、C符合要求.
故选BC.
点评:本题难度不是很大,主要考查学生根据化学方程式和溶质质量分数综合分析和解决实际问题的能力,采用极端假设法是正确解答本题的关键.
解答:解:①假设2.4g全是镁,与50g盐酸恰好完全反应,设参加反应的盐酸的质量为x,
Mg+2HCl=MgCl2+H2↑
24 73
2.4g x
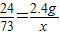 x=7.3g,
x=7.3g,则该盐酸的质量分数为:
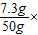 100%=14.6%;
100%=14.6%;②假设全是Fe,与50g盐酸恰好完全反应,设参加反应的盐酸的质量为y,
Fe+2HCl=FeCl2+H2↑
56 73
2.4g y
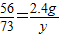 y≈3.1g,
y≈3.1g,则该盐酸的质量分数为
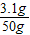 ×100%=6.2%.
×100%=6.2%.所以盐酸质量分数应在6.2%和14.6%之间.
B、C符合要求.
故选BC.
点评:本题难度不是很大,主要考查学生根据化学方程式和溶质质量分数综合分析和解决实际问题的能力,采用极端假设法是正确解答本题的关键.

练习册系列答案
相关题目