题目内容
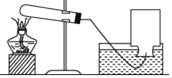
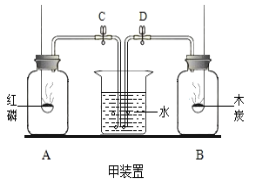
【题目】某同学探究了空气中氧气含量的测定实验之后,设计了如甲装置所示的实验,红磷和木炭均为足量,在空气中燃烧,待燃烧完毕,冷却到室温,分别打开C、D两处的止水夹.
(1)A集气瓶中的实验现象________________________ 。
(2)红磷燃烧的文字表达式________________________。
(3)在实验室测定空气中氧气的含量中,能否用木炭代替红磷______(填“能”或“不能”),理由是_____________ 。
(4)如果将甲装置改装成乙装置,其优点是_____________ 。从理论上分析,玻璃管内进水量约占玻璃管容积的五分之一,但实验测结果液面往往偏低,其原因可能是 _____________ 。(合理答案均可,只写一条),根据该实验可知,玻璃管内剩余的氮气的化学性质是: _____________ 。
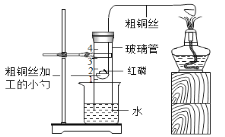
乙装置
【答案】产生大量的白烟,放出热量磷+ 氧气![]() 五氧化二磷不能 木炭燃烧会产生二氧化碳气体占据消耗氧气的体积,使得瓶内压强不变不污染环境红磷量不足等不能燃烧也不支持燃烧
五氧化二磷不能 木炭燃烧会产生二氧化碳气体占据消耗氧气的体积,使得瓶内压强不变不污染环境红磷量不足等不能燃烧也不支持燃烧
【解析】
(1)红磷燃烧产生大量的白烟,放出热量;
(2)红磷燃烧生成五氧化二磷,反应的文字表达式为:磷+ 氧气![]() 五氧化二磷;
五氧化二磷;
(3)碳与氧气反应生成二氧化碳,虽然都消耗了氧气,但又生成了气体,装置内气体压强保持不变,水不会进入集气瓶,所以不行;
(4)改进的实验可通过铜丝传导热量,使玻璃管中的铜丝和红磷反应,操作比甲简单、不污染环境;氧气占空气体积的五分之一,所以从理论上液面会上升到刻度1处;若液面偏低,可能是红磷太少或是由于反应放热,导致温度过高,气体膨胀;红磷熄灭后,集气瓶内剩下的气体主要是氮气,氮气 不能燃烧也不支持燃烧。

【题目】小明参观某养鱼池,发现农民向养鱼池中撒一种叫做过氧化钙的淡黄色固体用来增加鱼池中含氧量。小明学完氧气的实验室制法,于是他想可否用过氧化钙制取氧气。
(提出问题)过氧化钙可否用于制取氧气?
(查阅资料)部分内容如下:过氧化钙(CaO2)室温下稳定。在300℃时分解生成氧气,可作增氧剂、杀菌剂等。
(猜想与验证)(1)提出猜想:加热过氧化钙可制取氧气。
实验装置 | 实验主要过程 |
| ①验装置气密性,操作如下:先将导管伸入液面下,用手紧握试管,观察到有_____,松开手后,有液体进入导管; ②加入过氧化钙,加热,立即收集气体; ③收集满两瓶气体; ④停止加热。熄灭酒精灯前,应_____; ⑤第一瓶用来检验气体。方法是_____; ⑥点燃绑有铁丝的小木条,待小木条快燃尽时伸入到第二瓶气体中,观察到火星四射的现象,请写出该过程中发生反应的文字表达式:_____。 |
(2)验证过程中小明发现实验过程中第五步实验失败了,在老师的帮助下他分析出了原因。你觉得他失败的原因是:_____。
(实验结论)加热过氧化钙可制取氧气。