题目内容
【题目】(9分)盐酸是重要的无机化工产品,广泛用于染料、医药、食品、冶金等行业。
(1)实验室使用的稀盐酸通常都是将浓盐酸用水稀释而成的。现欲用溶质质量分数为37%的浓盐酸配制14.6%的稀盐酸100g。步骤为:计算、 、稀释。量取水时应选用规格为 (从10、50、100中选取)rnL的量筒。最后将稀盐酸转移到试剂瓶中,贴上标签备用,在标签上可以不必注明的是 (填字母序号)。
A.100g B.14.6% C.稀盐酸
(2)若用上述所配稀盐酸(100g溶质质量分数为14.6%)制取氢气,理论上可制得氢气多少克?(写出具体计算过程,注意格式)
(3)该稀盐酸还可用来测定镀锌铁皮锌镀层的质量。将该铁皮与足量稀盐酸反应,待产生的气泡明显减少时取出(此时可认为锌己反应完全,铁还未参与反应),洗涤,烘干,称量,减少的质量即为锌镀层的质量。下列实验操作对测定结果的影响,判断不正确的是 (填字母序号)。
A.铁皮未及时取出,会导致测定结果偏小
B.铁皮未洗涤干净,会导致测定结果偏大
C.烘干时间过长,会导致测定结果偏小
D.把稀盐酸换成稀硫酸,会导致测定结果偏大
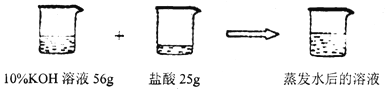
(4)取用上述所配稀盐酸25g与56g溶质质量分数为10%的氢氧化钾溶液相混合(含2滴酚酞试液),混合液刚好由红色变为无色,可认为恰好完全反应。将反应后所得溶液蒸发6.5g水(此过程中无晶体析出),求此时溶液的溶质质量分数。(写出具体计算过程,注意格式)
【答案】(1)量取 ;100 A;(2)0.4g; (3)ABD; (4)10%
【解析】
试题分析:(1)配置溶液的步骤为计算、量取、稀释。因为配置100g的溶液,故量取水时应选用规格为100ml; 的量筒。最后将稀盐酸转移到试剂瓶中,贴上标签备用,在标签上可以不必注明的是100g;
(2)设生成氢气为x;根据质量守恒定律可知,盐酸中氢元素的质量即为生成的氢气的质量,故 x=(100×14.6g)×2/36.5=0.4g;
(3)根据题中的要求可知,A.铁皮未及时取出,测量锌的质量偏大,会导致测定结果偏大;B.铁皮未洗涤干净,相当于测定的锌的质量偏小,会导致测定结果偏小;C.烘干时间过长,铁与氧气反应,导致测量的铁的质量增大,会导致测定结果偏小是正确的叙述;D.把稀盐酸换成稀硫酸,会导致测定结果偏大是错误的叙述,与酸的种类无关;
(4)设生成氯化钾的质量为x;
KOH+HCl==KCl+H2O
56 74.5
56×10% x
56/(56×10%)=74.5/X x=7.45g
溶液的质量为:56g+25g-6.5g=74.5g
溶液的溶质质量分数为:7.45g/74.5g×100%=10%

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案