题目内容
【题目】氢化镁(化学式为 MgH2)是一种常用的焰火剂,某兴趣小组拟选用如图装置制备氢化镁。

(查阅资料)氢化镁可用氢气与纳米级镁粉加热制得。氢化镁遇水反应生成氢氧化镁[Mg(OH)2 和氢气,并放出热量。常温下镁不与水反应,标准状况下氢气的密度为 0.09g/L。
(实验步骤)①先连接装置,再……;
②装入药品,打开分液漏斗活塞向装置中通入氢气,D 处收集的气体验纯后,给 C 装置加热。继续通入平稳的氢气流。
③实验结束时,先停止加热,等装置冷却到室温停止通入氢气。……
回答下列问题:(1)请将步骤①中的操作补充完整_____。
(2)装置A中用分液漏斗添加稀硫酸的优点是_____。
(3)实验开始时要“先通氢气”的目的,除防止氢气遇到热的空气引起爆炸外,还有_____。B装置的作用是_____。
【答案】检查装置的气密性 方便随时添加药品 防止镁与氧气、氮气等发生反应 干燥气体或者除去水蒸气 。
【解析】
(1)气体制备过程中要保证装置的气密性,所以步骤①中的操作补充完整为检查装置的气密性。
(2)装置A中用分液漏斗添加稀硫酸的优点是方便随时添加药品。
(3)由于镁能够和氮气和氧气反应,所以实验开始时要“先通氢气”的目的,除防止氢气遇到热的空气引起爆炸外,还有 防止镁与氧气、氮气等发生反应。B装置的作用是 干燥气体或者除去水蒸气
故答案为:
(1)检查装置的气密性。
(2)方便随时添加药品。
(3)防止镁与氧气、氮气等发生反应。 干燥气体或者除去水蒸气。

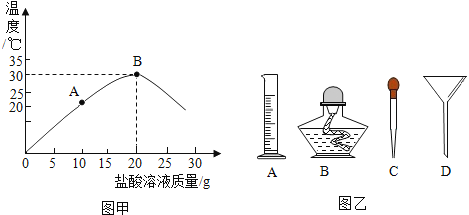
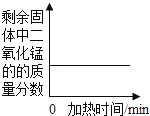
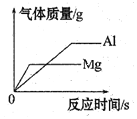
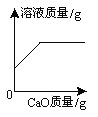
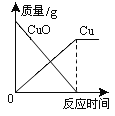
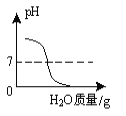
【题目】下列4个坐标图分别示意实验过程中某些量的变化,其中正确的是( )
A | B | C | D |
向一定量的石灰水中通入二氧化碳 | 在某一密闭装置内 点燃红磷 | 加热一定量高锰酸钾和二氧化锰的混合物 | 向一定量石灰石中滴加稀盐酸 |
|
|
|
|
A. A B. B C. C D. D
【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究井帮忙填写空格(包括表中的空格)。
(提出问题)化学反应前后各物质的质量总和是否相等?
(查阅资料)氢氧化钠溶液可以吸收二氧化碳气体
(猜想与假设)猜想1:不相等;猜想2:相等
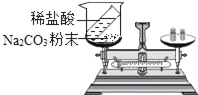
(实验探充)甲、乙两组同学用托盘天平分别称量反应前后物质的质量
甲组 | 乙组 | |
实验方案(反应后略) |
|
|
实验现象 | 有气泡产生,天平指针向右偏转,化学方程式为_____ | _____,天平指针没有偏转 |
结论 | 猜想1正确 | 猜想2正确 |
(反思评价)究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在_____中进行。
(得出结论)同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论:_____的各物质的质量总和等于反应后生成的各物质的质量总和。
(解释应用)
解释:化学反应前后,_____的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定有_____种元素组成。