题目内容
【题目】为测定某碳酸钠和氯化钠混合粉末中碳酸钠的含量,小冰同学进行了如下实验。请回答下列问题:
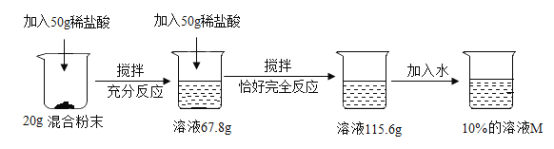
(1)上述实验过程中发生反应的化学方程式为_____;
(2)根据已知条件列出求解第一次所加的稀盐酸中溶质质量(x)的比例式_____;
(3)此混合粉末中碳酸钠的质量分数为_____;
(4)用36. 5%的浓盐酸配制100g上述稀盐酸,所需浓盐酸的质量为_____;
(5)加入水的质量为_____;
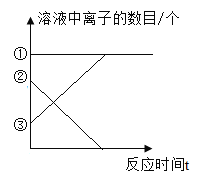
(6)在加入稀盐酸的过程中,如图中①表示的是_____ (填离子符号,下同),②表示的是__, ③表示的是_____。
【答案】![]()
![]() 53% 20g 92.7g Na+ CO32- C1-
53% 20g 92.7g Na+ CO32- C1-
【解析】
(1)碳酸钠会和稀盐酸发生反应生成氯化钠、水和二氧化碳,反应的化学方程式为![]() ;
;
(2)第一次加入稀盐酸后,溶液的质量为67.8g,相比之前的70g减少了2.2g,故产生了二氧化碳的质量为2.2g,则第一次所加的稀盐酸中溶质质量(x)的比例式为![]() ;
;
(3)设此混合粉末中碳酸钠的质量为y,反应前溶液质量为20g+50g+50g=120g,反应后溶液质量为115.6g,故产生的二氧化碳气体的质量为120g-115.6g=4.4g;则y的计算过程如下:
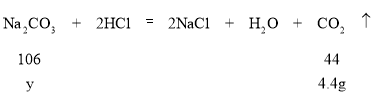
![]() ,解得y=10.6g,样品质量为20g,故碳酸钠的质量分数为
,解得y=10.6g,样品质量为20g,故碳酸钠的质量分数为![]() ;
;
(4)设上述稀盐酸中溶质的质量为z,计算过程如下:
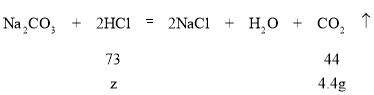
![]() ,解得z=7.3g,上述100g稀盐酸溶液中溶质质量为7.3g,用36.5%的浓盐酸溶液提供7.3g溶质,故所需浓盐酸的质量为
,解得z=7.3g,上述100g稀盐酸溶液中溶质质量为7.3g,用36.5%的浓盐酸溶液提供7.3g溶质,故所需浓盐酸的质量为![]() ;
;
(5)100g上述盐酸溶液中溶质的质量为7.3g,则需加水100g-7.3g=92.7g;
(6)①的离子的数目随着反应的进行没有发生变化,即没有参加反应,则①是钠离子;
②的离子的数目随着反应的进行逐渐减小直至为0,即该离子参与了反应且被消耗,则②是碳酸根离子;
③的离子的数目随着反应的进行逐渐增多,说明③是一直加入且未被消耗的离子,则③是氯离子。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案