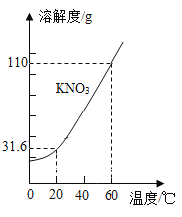
题目内容
【题目】下列关于反应的描述对应方程式完全正确的是( )
A.铝的自我保护 4Al+3O2=2Al2O3
B.验证铜和银的活动性 Cu+2AgCl=CuCl2+2Ag
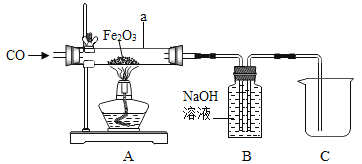
C.高炉炼铁原理 Fe3O4+4CO![]() 3Fe+4CO2
3Fe+4CO2
D.将铁片投入足量的稀盐酸中 2Fe+6HCl=2FeCl3+3H2↑
【答案】A
【解析】
A. 铝在常温下,与空气中的氧气反应生成一层致密的氧化物薄膜,阻止铝进一步氧化,4Al+3O2=2Al2O3,此选项正确;
B. AgCl难溶于水,不能与铜反应,可溶性的盐可与某金属单质反应,所以不能验证铜和银的活动性,此选项错误;
C. 高炉炼铁原理是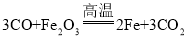 ,此选项错误;
,此选项错误;
D. 将铁片投入足量的稀盐酸中,发生的反应是:Fe+2HCl=FeCl2+H2↑,此选项错误。
故选A。

 名校课堂系列答案
名校课堂系列答案【题目】向盛有10mL NaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如下:
加入稀盐酸的体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
烧杯中溶液的pH | 12.9 | 12.7 | 12.5 | 12.3 | 11.9 | 7.0 | 2.1 | 1.9 |
(1)当加入稀盐酸的体积为___________ mL时,NaOH溶液和稀盐酸恰好完全反应,反应的化学方程式为_____________。
(2)当加入稀盐酸的体积为3mL时,溶液显________色;
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有:__________________。
【题目】Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
第1次 | 10 | m |
第2次 | 10 | 7.4 |
第3次 | 10 | 6.1 |
第4次 | 10 | 5.6 |
第5次 | 10 | n |
试回答下列问题:
(1)从以上数据可知,最后剩余的5.6g固体的成分是_____;表格中,m=_____,n=_____。
(2)黄铜样品中锌的质量分数为_____。
(3)计算所用稀硫酸中硫酸的质量分数为_____。