题目内容
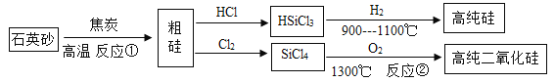
【题目】制备高纯硅和二氧化硅主要工艺流程如图所示。
(1)2019年,我国华为公司推出了5G商用芯片。制造芯片要用到高纯硅,硅的原子结构示意图_______。
(2)反应①的化学方程式为:SiO2+2C![]() Si+2CO
Si+2CO![]() ,这个反应体现了单质碳的___________性(填“氧化”或“还原”)。反应类型为__________反应。
,这个反应体现了单质碳的___________性(填“氧化”或“还原”)。反应类型为__________反应。
(3)二氧化硅属于________(填“酸”“碱”“盐”“氧化物”或“有机物”中的一种)。与碱反应时,二氧化硅与二氧化碳有相似的化学性质,装氢氧化钠的试剂瓶不能用玻璃塞,是因为常温下氢氧化钠与玻璃塞中的二氧化硅反应生成有粘性的硅酸钠,进而使瓶口与瓶塞粘合在一起的缘故,写出该反应的化学方程式_____________________________。
(4)用于制造光导纤维的高纯二氧化硅,可利用反应②制备,同时生成一种可循环使用的物质,该反应的化学方程式为______________________________。整个工艺流程中,还可以循环利用的另一种物质是__________________。
【答案】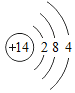 还原性 置换反应 氧化物
还原性 置换反应 氧化物 ![]()
![]() H2(或HCl)
H2(或HCl)
【解析】
(1)在元素周期表中,硅原子的原子序数为14,原子序数=核外电子数=14,第一层电子层有2个电子,第二层有8个电子,最外层电子数为4个,故硅的原子结构示意图: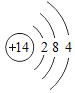 ;
;
(2)反应①的化学方程式为:SiO2+2C![]() Si+2CO
Si+2CO![]() ,从化学方程式可以看出,此反应中,碳元素得到氧生成了一氧化碳,故这个反应体现了单质碳的还原性。该反应符合一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;
,从化学方程式可以看出,此反应中,碳元素得到氧生成了一氧化碳,故这个反应体现了单质碳的还原性。该反应符合一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;
(3)二氧化硅是由两种元素组成,其中一种元素为氧元素的化合物,属于氧化物;
二氧化碳与氢氧化钠反应生成碳酸钠和水,二氧化硅与二氧化碳有相似的化学性质,二氧化硅与氢氧化钠反应生成硅酸钠和水,其化学反应方程式为:![]() ;
;
(4)用于制造光导纤维的高纯二氧化硅,可利用反应②制备,同时生成一种可循环使用的物质,该反应的化学方程式为:![]() ;
;
粗硅制取高纯硅的化学反应方程式为:![]() ;
;![]() ,H2和HCl既是反应物又是生成物,可以循环利用,故整个工艺流程中,还可以循环利用的另一种物质是H2(或HCl)。
,H2和HCl既是反应物又是生成物,可以循环利用,故整个工艺流程中,还可以循环利用的另一种物质是H2(或HCl)。

 阅读快车系列答案
阅读快车系列答案【题目】探究纯碱成分。我国科学家侯德榜在氨碱法的基础上创立了候氏制碱法,其生产流程简明如下图:
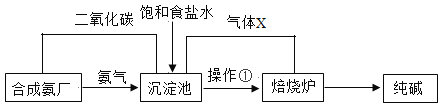
请根据流程图回答下面问题:
(1)写出沉淀池中发生反应的化学方程式___________。
(2)上述流程中气体X的化学式是___________
(3)沉淀池中晶体转移至熔烧炉时用到操作①,操作①的名称是____________。
(4)用“侯氏制碱法”制得的纯碱中可能含有碳酸氢钠、氯化钠等杂质,化学兴趣小组对某品牌纯碱样品的成分及含量进行了实验探究
(定性实验)探究样品的成分
实验步骤 | 实验现象 | 实验结论. |
_______ | _______ | 样品中不含碳酸氢钠 |
_______ | _______ | 样品中含有氯化钠 |
(定量实验)利用样品与稀盐酸反应,测定Na2CO3的质量分数。实验装置(铁架台略去)如下图所示。(装置气密性良好,忽略盐酸的挥发性且每步反应成作用都是完全的)。
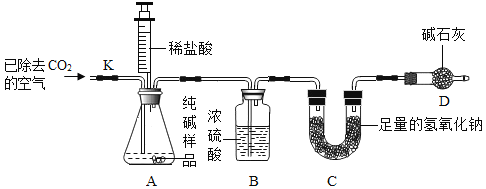
实验步骤:
1检查装置的气密性,将6g纯碱样品放入锥形瓶中
2称量反应前C装置质量为50g
3组装装置,用注射器向A中加入50mL稀盐酸时,A中不再产生气泡。
4打开止水夹K,通入已除去CO2的空气,一段时间后关闭止水夹
5称量装置C反应后的质量为52.2g
(5)①评价方案:步骤4的作用是______________,缺少装置B,将会使测定结果____________(选填“偏大”成“偏小“或“不变”).
②根据题中的数据计算纯碱样品中碳酸钠的质量分数为____________(计算结果精确到0.1%)。
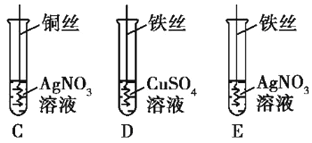
【题目】下图为某小组探究金属化学性质的两组实验。
实验I | 实验II |
|
|
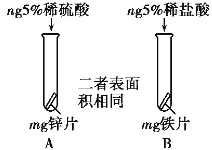
①实验I中以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为该实验设计不够合理,理由是______________;
②写出实验II中C试管内反应的化学方程式_____________;
③实验II中要验证Cu、Fe、Ag的金属活动性顺序,至少要做的实验是_____(填字母序号)。