题目内容
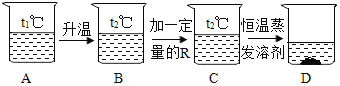
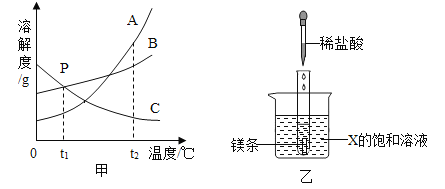
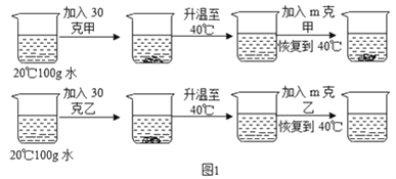
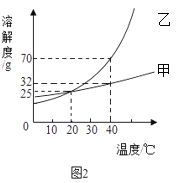
【题目】某同学将甲、乙固体各30g分别加入100g水中后,进行了如图1所示的实验。甲乙两种固体的溶解度曲线如图2所示。
请回答:
(1)20℃时,将20g甲放入50g水中充分溶解,所得溶质的质量分数为_____;
(2)当乙中混有少量甲时,提纯乙所采用的方法是_____;
(3)m的取值范围_____。
(4)40℃时,取等质量的甲、乙两种物质的饱和溶液分别蒸发等量的水后,恢复到40℃。下列说法正确的是_____(填字母)。
A 恢复到原温度后,溶液中溶剂的质量:甲=乙
B 恢复到原温度后,析出晶体的质量:乙>甲
C 若再降温到20℃时,溶液的质量:甲>乙
D 若再降温到20℃时,溶液的溶质质量分数:甲=乙
【答案】20% 降温结晶 2g<m≤40g BCD
【解析】
(1)20℃时,由于甲的溶解度为25g,所以50g水中只能溶解12.5g,所以将20g甲放入50g水中充分溶解时,只有12.5g溶解,所得溶质的质量分数为![]() ×100%=20%,故填:20%;
×100%=20%,故填:20%;
(2)由图知,乙的溶解度受温度的影响较大,甲的溶解度受温度的影响不大,所以当乙中混有少量甲时,提纯乙所采用的方法是降温结晶,故填:降温结晶;
(3)由于甲在20℃时,溶解度为25g,40℃时,溶解度为32g,20℃时,加入30g甲,升温到40℃时还可以再溶解2g,所以升高温度时加入mg有晶体析出,m的质量应大于2g;由于乙在20℃时,溶解度为25g,40℃时,溶解度为70g,,20℃时,加入30g乙,升温到40℃时还可以再溶解40g,所以升高温度时加入mg无晶体析出,m的质量应小于等于40g。所以m的取值范围2g<m≤40g;故填:2g<m≤40g;
(4)40℃时,取等质量的甲乙两种物质的饱和溶液分别蒸发等量的水后,恢复到40℃,由于乙的溶解度比甲大,原等质量的溶液中甲的溶剂比乙多,蒸发等质量的水后留下的溶剂仍是甲多,故A错误;恢复到原温度后,由于乙的溶解度大,所以析出晶体的质量:乙>甲;降到20℃后,由于乙析出的晶体多,所以留下的溶液的质量就少,所以溶液的质量:甲>乙;降温到20℃时,两者的溶解度相同,所以溶液的溶质质量分数:甲=乙。故填:BCD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某公司生产的新型融雪剂的成分是无水CaCl2和少量的氯化钠,为测定融雪剂中氯化钙的含量,化学兴趣小组的同学称取该样品12g,加水充分溶解,得到溶液50g,然后取一定质量分数的碳酸钠溶液100g平均分五次加入,充分振荡,实验数据见表。请你分析数据并进行有关计算。
次 数 | 1 | 2 | 3 | 4 | 5 |
加入碳酸钠溶液的质量/g | 20 | 20 | 20 | 20 | 20 |
生成沉淀的质量/g | 2.5 | x | 7.5 | 10 | 10 |
(1)上表中x的数值为_____。第_____次加入的碳酸钠与氯化钙恰好完全反应。
(2)样品中氯化钙的质量分数是多少_____?
(3)恰好完全反应时过滤,所得不饱和溶液的溶质质量分数是多少_____?
【题目】碳酸氢钠是小苏打的主要成分,在生产和生活中有许多重要的用途。化学课上,同学们为了解碳酸氢钠的性质,将一定质量的碳酸氢钠和稀硫酸混合,充分反应后,有气体逸出,该反应的化学方程式为2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外可能还含有其他成分,因此进行了猜想并做了如下实验:
(实验用品)pH试纸、锌片、氧化铜粉末、稀硫酸、氢氧化钠溶液、氯化钡溶液。
(猜想与假设)反应后溶液总溶质的可能组成成分。
猜想一:硫酸钠
猜想二:硫酸钠、_____(填名称或化学式均可)。
猜想三:硫酸钠、硫酸
(实验探究)同学们取反应后的溶液用不同方案进行如下实验,请根据结论完成如表实验现象中的空格。
实验方案 | A | B | C | D |
实验操作 |
|
|
|
|
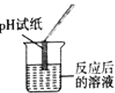
实验现象 | _____ | 产生白色沉淀 | 试纸变色,对照标准比色,pH<7 | _____ |
实验结论 | 猜想二不正确 | 猜想三正确 | 猜想三正确 | 猜想三正确 |
(得出结论)猜想三正确。
(评价反思)
(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在一处明显操作错误是:_____。
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由_____。
(总结提高)依据所给实验用品,设计不同的方案确认猜想三是正确的,请你写出你的实验方案_____。