题目内容
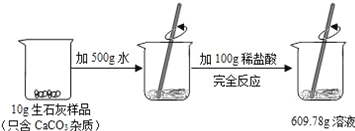
【题目】欲测定盐酸与氯化钙混合液中氯化钙的质量分数,进行如下实验:取混合溶液100g于锥形瓶中,向其中逐渐加入溶质质量分数为10. 6%的碳酸钠溶液(如图一),并不断测定锥形瓶中溶液的pH.反应过程中所得溶液的pH与锥形瓶中物质的总质量的关系如图二所示。(提示:忽略CO2在水中溶解的量:氯化钙溶液显中性.)
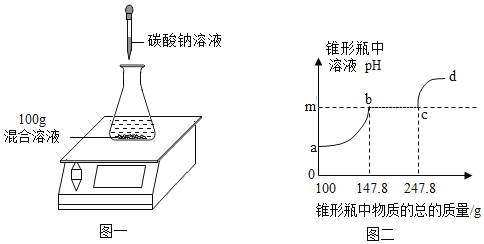
(1)m点的数值是_____。
(2)a→b段表示碳酸钠与混合溶液中的_____反应。
(3)请计算原混合溶液中CaCl2的质量分数。_____(写计算过程)。
【答案】7 盐酸 11.1%
【解析】
(1)盐酸显酸性,根据图可以看出碳酸钠先和盐酸反应然后和氯化钙反应,所以m溶液变成中性对应的pH为7;
(2)a→b为碳酸钠与混合溶液中的盐酸反应;
(3)b→c和氯化钙反应的碳酸钠溶液的质量为247.8g-147.8g=100g,
设原混合溶液中CaCl2的质量分数为y,
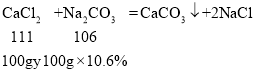
![]()
y=11.1%。

【题目】我国是一个钢铁大国,钢铁产量为世界第一。某化学实验小组的同学用下面的装置在实验室中模拟炼铁。请你和他们一起完成相关探究。
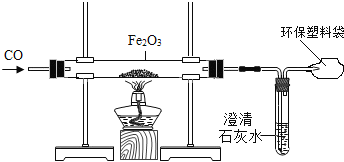
(1)操作顺序是实验成败的关键,对于该实验,应______________________(填“先通入一氧化碳”或“先点燃酒精灯”)。
(2)反应中可观察到粗玻璃管内的固体逐渐由_________色变成__________色,写出该反应的化学方程式____________________。
(3)产物的检验:
①初步检验:甲同学想对反应后的产物进行初步检验,请你帮他想出一个物理方法:____。
②进一步验证:乙同学想用化学方法对产物进一步验证,他将反应后的黑色粉末加入足量的硫酸铜溶液中,发现只有部分变红。请写出生成红色物质的化学方程式:_____。
(4)质疑与探究:
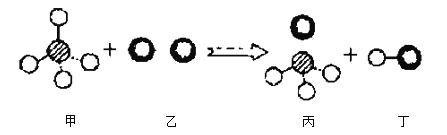
①乙同学对产物的成分产生了质疑,查阅相关资料之后得知,一氧化碳还原氧化铁是一个逐渐的过程。
首先是Fe2O3被还原为Fe3O4:3Fe2O3 + CO ![]() 2Fe3O4 + CO2。
2Fe3O4 + CO2。
然后是Fe3O4被还原为FeO:______![]() ______。
______。
最后是FeO被还原为Fe:FeO + CO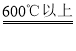 Fe + CO2
Fe + CO2
②通过以上分析,甲乙两位同学对反应后黑色固体的成分进行了猜想:
已知:FeO、Fe3O4均为黑色,且Fe3O4有磁性。FeO、Fe3O4都不与硫酸铜溶液反应。
猜想一:Fe与Fe3O4; 猜想二:Fe与FeO; 猜想三:Fe与Fe3O4和FeO。
③为了对产物固体的成分进行更客观的分析,甲乙同学将所做实验整理如下:
实验内容 | 实验现象 | 实验结论 |
将反应后得到的黑色粉末 用磁铁吸引 | ________ | 猜想一 成立 |
将反应后得到的黑色粉末 加入足量的硫酸铜溶液中 | ________ |
④实验反思:为了提高铁的产率,应适当________(填“降低”或“提高”)反应温度。