题目内容
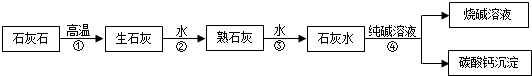
用贝壳、海水为原料通过下列反应:
①CaCO3
CaO+CO2↑
②CaO+H2O═Ca(OH)2
③Ca(OH)2+MgCl2(海水)═Mg(OH)2↓+CaCl2
④Mg(OH)2+2HCl═MgCl2+2H2O
从海水中提取氯化镁,其中没有涉及的反应类型是( )
①CaCO3
| ||
②CaO+H2O═Ca(OH)2
③Ca(OH)2+MgCl2(海水)═Mg(OH)2↓+CaCl2
④Mg(OH)2+2HCl═MgCl2+2H2O
从海水中提取氯化镁,其中没有涉及的反应类型是( )
分析:根据化学反应的基本类型的种类及反应的特点,分析此过程中物质间的化学反应,可知反应过程中涉及到的反应类型,没有涉及到的反应类型.
解答:解:由题意可知,此过程发生反应由:①CaCO3
CaO+CO2↑;②CaO+H2O═Ca(OH)2;③Ca(OH)2+MgCl2(海水)═Mg(OH)2↓+CaCl2;④Mg(OH)2+2HCl═MgCl2+2H2O.
化合反应的特点“多变一”;分解反应的特点“一变多”;复分解反应的特点是两种化合物相互交换成分,生成另外两种化合物;置换反应的特点是单质和化合物生成单质和化合物,由此可知该过程没有涉及的反应类型是置换反应.
故选D.
| ||
化合反应的特点“多变一”;分解反应的特点“一变多”;复分解反应的特点是两种化合物相互交换成分,生成另外两种化合物;置换反应的特点是单质和化合物生成单质和化合物,由此可知该过程没有涉及的反应类型是置换反应.
故选D.
点评:本题以海洋资源的开发和利用为研究性学习的课题,视角新颖,中考题目以这种方式出现,以化学学科知识结合生活、生产、社会问题展开,增强了学生问题意识、探究意识和研究欲望.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


 海水是一种化学成分复杂的混合物,除了水还包括溶解于水中的丰富的矿物质和少量气体.以海水为原料可以生产许多化工产品:如氯化钠、氢气、镁、食用加碘盐等.
海水是一种化学成分复杂的混合物,除了水还包括溶解于水中的丰富的矿物质和少量气体.以海水为原料可以生产许多化工产品:如氯化钠、氢气、镁、食用加碘盐等.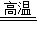 CaO+CO2↑
CaO+CO2↑