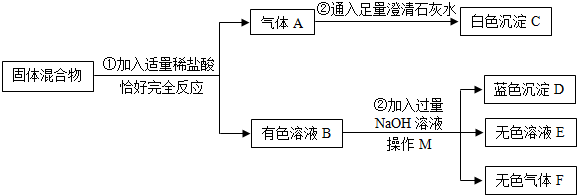
题目内容
如图所示,向盛水的烧杯中放入一小粒品红,一段时间后,烧杯中形成红色溶液,此实验能说明 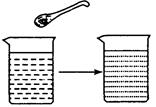
①分子处于不断运动之中 ②分子大,原子小 ③分子可再分,原子不能再分 ④分子之间有间隔
| A.①② | B.②③ | C.①③ | D.①④ |
D
解析试题分析:盛水的烧杯中放入一小粒品红,一段时间后,烧杯中形成红色溶液,这是因为,品红和水的微粒之间有间隔,并且不断运动的结果。选D。
考点:微粒的性质。
点评:微粒的性质有:微粒很小;微粒不断运动;微粒之间有间隔。

练习册系列答案
相关题目
 2、如图所示,在盛有水的烧杯中,等质量的铁圈和银圈的连接处吊着一根绝缘的细线(两圈不接触),使之平衡.小心地从烧杯中央滴入硫酸铜溶液,观察到的现象是( )
2、如图所示,在盛有水的烧杯中,等质量的铁圈和银圈的连接处吊着一根绝缘的细线(两圈不接触),使之平衡.小心地从烧杯中央滴入硫酸铜溶液,观察到的现象是( ) 碱式碳酸镁密度小,是橡胶制品的优良填料.其组成一般以xMgCO3?yMg(OH)2?zH2O表示.
碱式碳酸镁密度小,是橡胶制品的优良填料.其组成一般以xMgCO3?yMg(OH)2?zH2O表示.