题目内容
【题目】某实验小组的同学用氢氧化钠溶液和稀硫酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀硫酸一会儿后,发现忘记了滴加指示剂。此时,他们停止滴加稀硫酸,并对烧杯内溶液中溶质的成分进行探究。
(1)Ⅰ.写出该中和反应的化学方程式。
(2)Ⅱ.探究烧杯内溶液中溶质的成分:
【提出问题】该烧杯内溶液中溶质是什么?
【进行猜想】
猜想一:可能是Na2SO4与NaOH ;猜想二:可能只是Na2SO4 ;猜想三:可能是。
(3)【查阅资料】Na2SO4溶液呈中性。
【实验探究】
实验步骤 | 实验现象 | 实验结论 |
①取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡 | 猜想一不正确 | |
②取少量烧杯内溶液于另一支试管中,滴加碳酸钠溶液 | 猜想二不正确,猜想三正确 |
(4)【反思与拓展】
探究猜想三成立,除以上方案外,下列哪些物质也能完成该实验?(填序号)
A.pH试纸
B.铜
C.氧化铜
D.氢氧化铜
(5)甲、乙两位同学准备测定反应后溶液中H2SO4的质量分数。
①甲同学取50g该溶液于烧杯中,逐滴滴入溶质质量分数为10%的NaOH溶液,反应过程中溶液的pH变化如右图所示,求溶液中H2SO4的质量分数。(写出计算过程)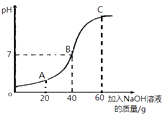
②试写出A点溶液中的溶质。
③乙同学改用BaCl2溶液代替NaOH溶液,根据生成沉淀的质量来确定溶液中H2SO4的质量分数,你认为结果将(填“偏大”“偏小”或“无影响”)。
【答案】
(1)2NaOH+H2SO4=Na2SO4+2H2O
(2)Na2SO4和H2SO4
(3)不变色,有气泡生成
(4)A,C,D
(5)9.8%,Na2SO4、H2SO4,偏大
【解析】(1)氢氧化钠与稀硫酸反应生成硫酸钠和水,反应的化学方程式表示为:2NaOH+H2SO4=Na2SO4+2H2O;【进行猜想】氢氧化钠若与稀硫酸恰好完全反应,那么反应后的溶质是硫酸钠;若氢氧化钠过量,那么溶质是硫酸钠和氢氧化钠;若硫酸过量,那么溶质是硫酸钠和硫酸;【实验探究】氢氧化钠呈碱性,能使无色的酚酞试液变成红色,现猜想一不正确,那么取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,无色酚酞不变色;猜想三是硫酸钠和硫酸,硫酸能与碳酸钠反应生成二氧化碳气体,故取少量烧杯内溶液于另一支试管中,滴加碳酸钠溶液,能观察到产生大量的气泡;【反思与拓展】(1)探究猜想三成立,实际就是要证明溶液中含有硫酸,可根据硫酸的性质选择药品。A、硫酸呈酸性,pH<7,正确;B、铜不能与稀硫酸反应,错误;C、稀硫酸能与氧化铜反应生成硫酸铜和水,正确;D、稀硫酸能与氢氧化铜反应生成硫酸铜和水,正确;故选ACD。(5)稀硫酸与氢氧化钠反应生成硫酸钠和水,当溶液的pH=7时,表示稀硫酸与氢氧化钠恰好完全反应。利用化学方程式,根据硫酸与氢氧化钠反应的质量比即可计算出溶液中硫酸的质量。
①由图可知稀硫酸与氢氧化钠恰好完全反应时消耗的氢氧化钠溶液的质量为40g,溶质氢氧化钠的质量=40g ![]() 10%=4g
10%=4g
设稀硫酸中溶质的质量为x;
2NaOH + | H2SO4 = Na2SO4 + 2H2O |
80 | 98 |
4g | x |
![]() x=4.9g
x=4.9g
溶液中H2SO4的质量分数= ![]() 9.8%
9.8%
②A点的pH<7,说明硫酸过量,那么溶液中的溶质是硫酸和硫酸钠;
③BaCl2溶液除了能与硫酸反应生成硫酸钡沉淀外,还能与硫酸钠反应生成硫酸钡沉淀,故用BaCl2溶液代替NaOH溶液,根据生成沉淀的质量来确定溶液中H2SO4的质量分数,结果会偏大。
【考点精析】解答此题的关键在于理解中和反应及其应用的相关知识,掌握中和反应:酸与碱作用生成盐和水的反应,以及对书写化学方程式、文字表达式、电离方程式的理解,了解注意:a、配平 b、条件 c、箭号.

 阅读快车系列答案
阅读快车系列答案