题目内容
(2008?江宁区一模)我区某中学化学研究性学习小组为了探究水垢的成因和主要成分,从教材和互联网上查得如下资料:Ⅰ.锅炉用水硬度高了十分危险,因为锅炉内结垢后不仅浪费燃料,而且会使锅炉内管道局部过热,易引起管道变形或损坏,严重时还可能引起爆炸.
Ⅱ.用适量的盐酸可以将热水瓶胆壁上的水垢[主要成分是Mg(OH)2和CaCO3]除去.
Ⅲ.天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质--水垢.
(1)小李同学对该井水进行如下探究,其做法及结论合理的是______.(填序号)
A、用烧杯取少量该井水,加入适量肥皂水,搅拌,发现有较多浮渣产生,说明该井水为硬水.
B、用烧杯取少量井水,加入一定量活性炭,搅拌、过滤,可吸附井水中的钙、镁离子,并使井水软化.
C、取较多井水,加热煮沸,煮沸后的井水硬度降低.
(2)某同学为了粗略测定某锅炉水垢中CaCO3的质量分数,取6.0g 样品,逐滴加入稀盐酸至不再产生气泡为止,共生成2.2g CO2气体.试计算样品中CaCO3的质量分数.
(3)若要计算上述反应所消耗的盐酸溶液的质量分数,题中还缺少的一个数据是______.
(4)乙同学设计了下列实验装置进一步探究水垢的成分.其主要操作步骤如下:
①按图组装仪器,将50g水垢试样放入锥形瓶中,加入足量某酸溶液;
②测量一定时间内干燥管内物质增加的质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变.
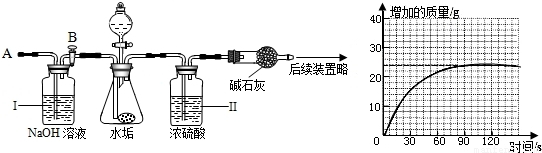
研究性小组的同学通过简单计算,认为水垢中一定含有少量MgCO3,理由是______.
【答案】分析:(1)分析做法的目的,根据所进行的操作或所选用的药品,判断是否可达到最初设想;
(2)根据反应的化学方程式,由生成二氧化碳的质量计算样品中碳酸钙的质量,求得样品中碳酸钙的质量分数;
(3)根据计算溶液的溶质质量分数的方法,推断还缺少的计算数据;
(4)根据题意,干燥管因吸收二氧化碳质量增加,根据所测得增加量可得到反应放出二氧化碳的质量,通过计算比较水垢中碳酸钙放出二氧化碳质量与所测得二氧化碳质量的关系,对判断进行解释.
解答:解:(1)通常使用肥皂水区别硬水与软水,由于井水有较多浮渣产生,可判断该井水为硬水;活性炭只能除去水中有色、有味杂质而不能减少钙、镁离子含量,即不能使用活性炭来降低水的硬度;通过加热可使水中钙、镁离子形成沉淀而减小水的硬度;故AC的做法及结论合理;
故答案为:AC;
(2)设6.0g锅炉水垢样品中CaCO3的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.2g
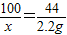 x=5.0g
x=5.0g
锅炉水垢样品中碳酸钙的质量分数=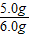 ×100%=83.3%
×100%=83.3%
答:锅炉水垢样品中碳酸钙的质量分数为83.3%.
(3)根据反应生成二氧化碳的质量可计算中所使用稀盐酸中溶质的质量,但因缺少稀盐酸溶液的质量而不能计算出稀盐酸的溶质质量分数;
(4)由实验数据可得,反应放出二氧化碳的质量为24g;假设50g水垢全部为碳酸钙,设与盐酸反应所产生二氧化碳的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
50g y
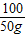 =
=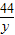 y=22g<24g
y=22g<24g
即使水垢全部为碳酸钙,与盐酸完全反应后所产生二氧化碳质量还小于实验中所测定的二氧化碳气体,因此,水垢中应含有能产生出更多二氧化碳的碳酸镁;
故答案为:
(3)稀盐酸的质量(其他合理答案也可);
(4)即使50g水垢全部为CaCO3,产生CO2的质量应为22g,而实验测得生成的CO2质量>22g.
点评:本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.
(2)根据反应的化学方程式,由生成二氧化碳的质量计算样品中碳酸钙的质量,求得样品中碳酸钙的质量分数;
(3)根据计算溶液的溶质质量分数的方法,推断还缺少的计算数据;
(4)根据题意,干燥管因吸收二氧化碳质量增加,根据所测得增加量可得到反应放出二氧化碳的质量,通过计算比较水垢中碳酸钙放出二氧化碳质量与所测得二氧化碳质量的关系,对判断进行解释.
解答:解:(1)通常使用肥皂水区别硬水与软水,由于井水有较多浮渣产生,可判断该井水为硬水;活性炭只能除去水中有色、有味杂质而不能减少钙、镁离子含量,即不能使用活性炭来降低水的硬度;通过加热可使水中钙、镁离子形成沉淀而减小水的硬度;故AC的做法及结论合理;
故答案为:AC;
(2)设6.0g锅炉水垢样品中CaCO3的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.2g
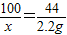 x=5.0g
x=5.0g锅炉水垢样品中碳酸钙的质量分数=
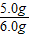 ×100%=83.3%
×100%=83.3%答:锅炉水垢样品中碳酸钙的质量分数为83.3%.
(3)根据反应生成二氧化碳的质量可计算中所使用稀盐酸中溶质的质量,但因缺少稀盐酸溶液的质量而不能计算出稀盐酸的溶质质量分数;
(4)由实验数据可得,反应放出二氧化碳的质量为24g;假设50g水垢全部为碳酸钙,设与盐酸反应所产生二氧化碳的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
50g y
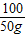 =
=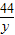 y=22g<24g
y=22g<24g即使水垢全部为碳酸钙,与盐酸完全反应后所产生二氧化碳质量还小于实验中所测定的二氧化碳气体,因此,水垢中应含有能产生出更多二氧化碳的碳酸镁;
故答案为:
(3)稀盐酸的质量(其他合理答案也可);
(4)即使50g水垢全部为CaCO3,产生CO2的质量应为22g,而实验测得生成的CO2质量>22g.
点评:本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.

练习册系列答案
相关题目







