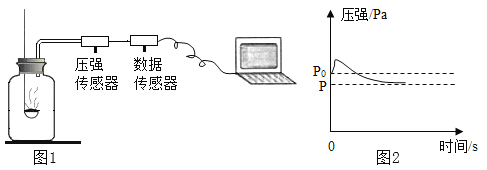
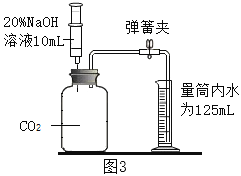
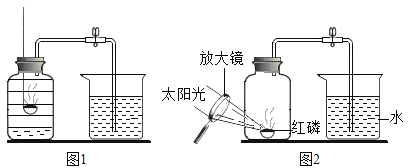
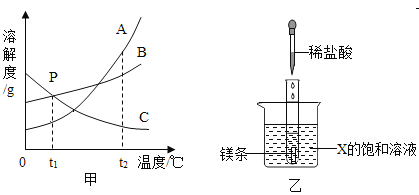
题目内容
【题目】某同学去10g黄铜(铜、锌合金)样品放入盛有200g溶质质量分数为4.9%稀硫酸的烧杯中,恰好完全反应,试计算:
(1)将质量分数为98%的浓硫酸稀释成200g溶质质量分数为4.9%稀硫酸,需加水的质量为_____g。
(2)该黄铜样品中锌的质量_____,产生氢气质量为_____。
(3)恰好完全反应后所得溶液中溶质的质量分数_____(计算结果精确到0.1%)。
【答案】190g 6.5 0.2 7.8%
【解析】
(1)200g溶质质量分数为4.9%稀硫酸中溶质的质量为200g×4.9%=9.8g,含9.8g硫酸的98%的浓硫酸的质量为:9.8g÷98%=10g,故加入水的质量为:200g-10g=190g。
(2)设黄铜样品中锌的质量为x,生成氢气的质量为y,生成硫酸锌的质量为z
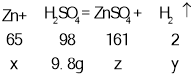
![]()
解得:x=6.5g,y=0.2g,z=16.1g
则黄铜样品中锌的质量为6.5g,产生氢气质量为0.2g。
(3)反应后溶液的总质量为:200g+6.5g-0.2g=206.3g
恰好完全反应后所得溶液中溶质的质量分数为:![]() 。
。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】活性炭可处理大气污染物NO。在一定条件下的密闭容器中,NO气体与活性炭中的C反应生成甲、乙两种气体,其中甲是空气中含量最多的气体。测得各物质的质量如下表所示:
物质质量 /g 反应时间/min | 活性炭 | NO | 甲 | 乙 |
0 | 28.72 | 5.00 | 0 | 0 |
4 | 28.00 | 1.40 | x | 2.64 |
下列说法正确的是( )
A. 生成甲、乙的分子数之比为1:1
B. 反应消耗的C与NO的质量之比为2:5
C. x的值为26.76
D. 反应中活性炭只起吸附作用
【题目】据统计,我国仅20世纪90年代就发生火灾约89万起,给人民造成重大损失。应用化学知识能有效预防和控制火灾。下面对图中灭火实例的灭火原理解释不正确的是( )

灭火实例 | 灭火原理 | |
A | 住宅失火时,消防队员用水灭火 | 降低可燃物的着火点 |
B | 酒精在桌上着火时,用湿抹布盖灭 | 隔绝空气或氧气 |
C | 炒菜油锅着火时,用锅盖盖熄 | 隔绝空气或氧气 |
D | 扑灭森林火灾时,设置隔离带 | 可燃物与燃烧物隔离 |
A. A B. B C. C D. D