题目内容
【题目】请你根据所学知识并结合下图所示装置回答有关问题:
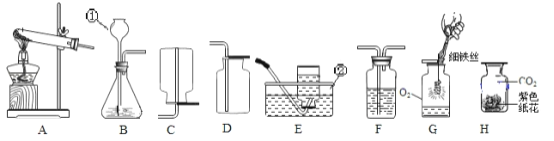
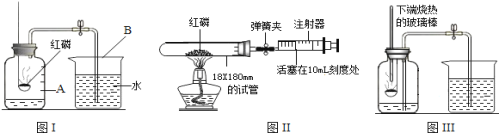
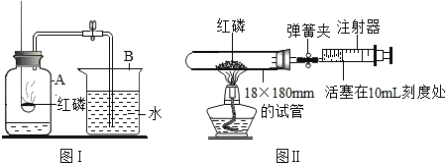
(1)指出标号仪器的名称:①__________________。
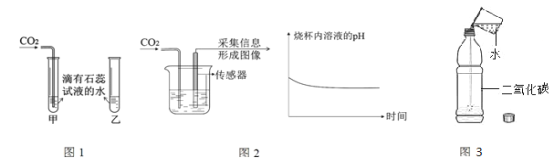
(2)用氯酸钾制取氧气的表达式为__________________________________,应选择的发生装置是________,可以用E装置收集氧气的原因是____________________,集满氧气的集气瓶应______________(填“正”或“倒”)放在桌面上。
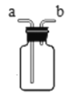
(3)实验室常用块状大理石与稀盐酸在常温下制取并收集一定量的二氧化碳,应选择的发生装置是__________,若用如图收集二氧比碳时,气体应从a管口进入,则你认为二氧化碳密度比空气______。(填“大”或“小”或“相等”)
(4)用收集到的氧气和二氧化碳分别完成如图G、H所示实验,G中集气瓶底部盛有少量水的原因是______。
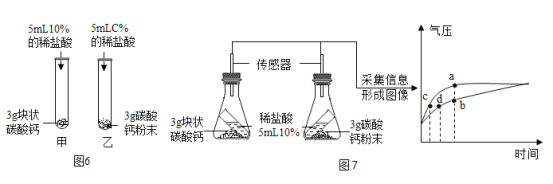
(5)实验室用过氧化氢溶液和二氧化锰制氧气的表达式为_________________________。某化学小组同学用20%的过氧化氢溶液和二氧化锰,并选用B装置来制氧气。实验中,同学们发现不能得到平稳的氧气流。大家提出从两个方面改进:
一是把发生装置由B中①改成分液漏斗,其理由是___________________________;
二是将过氧化氢溶液加水稀释。溶液的稀释后产生氧气的量将_______。(填“增加”或“减少”或“不变”)
【答案】长颈漏斗氯酸钾![]() 氯化钾+氧气A氧气不易溶于水正B大防止燃烧产生的高温熔化物掉到集气瓶底炸裂集气瓶过氧化氢
氯化钾+氧气A氧气不易溶于水正B大防止燃烧产生的高温熔化物掉到集气瓶底炸裂集气瓶过氧化氢![]() 水+氧气可以控制反应速率不变
水+氧气可以控制反应速率不变
【解析】
(1)标号仪器的名称:①长颈漏斗;
(2)文字表达式的书写方法:将反应物的名称写在箭头的左边,生成物的名称写在箭头的右边,箭头的上方标出反应条件。氯酸钾制在二氧化锰的作用下受热分解生成氧气和氯化钾,反应的表达式为:氯酸钾![]() 氯化钾+氧气,该反应是加热固体制取气体,应选择的发生装置是A,可以用E装置收集氧气的原因是氧气不易溶于水,氧气的密度比空气的大,集满氧气的集气瓶应正放在桌面上;
氯化钾+氧气,该反应是加热固体制取气体,应选择的发生装置是A,可以用E装置收集氧气的原因是氧气不易溶于水,氧气的密度比空气的大,集满氧气的集气瓶应正放在桌面上;
(3)实验室常用块状大理石与稀盐酸在常温下制取并收集一定量的二氧化碳,应选择的发生装置是固液常温型B,若用如图收集二氧比碳时,气体应从a管口进入,因为二氧化碳密度比空气大;
(4)用收集到的氧气和二氧化碳分别完成如图G、H所示实验,G中集气瓶底部盛有少量水的原因是防止高温的生成物溅落使集气瓶底炸裂;
(5)实验室用过氧化氢溶液和二氧化锰制氧气的表达式为:过氧化氢![]() 水+氧气,
水+氧气,
把发生装置由B中①改成分液漏斗可以得到平稳的氧气流,其理由是分液漏斗可以控制液体的滴加速率而控制反应速率;将溶液的浓度影响反应速率,不影响产物的多少,过氧化氢溶液加水稀释,稀释后产生氧气的速率变慢,氧气量不变。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案