题目内容
有一包粉末,可能由C、CuO、Fe三种物质中的一种或几种组成.某同学为了探究它的成分,按如下步骤进行实验:
(1)先对实验做了如下设想和分析:取少量粉末放入烧杯中,向烧杯中加入过量的稀硫酸,则实验中可能出现的现象与对应的结论如下表所示(表中未列完所有情况).请你完成下表:

(2)通过实验及分析,确定该粉末为C、CuO的混合物.
(3)为了进一步探究C、CuO的性质,他又利用这种混合物补充做了下面两个实验:
[实验1]将此粉末敞口在空气中灼烧完全,待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置,烧杯中________(填“有”或“无”)不溶物,溶液呈________色.
[实验2]将此粉末隔绝空气加热:(若炭完全反应)待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置.请回答:
①烧杯中________(填“有”或“无”)不溶物.
②若静置后溶液呈无色,则该溶液中溶质是________(写化学式).
③若静置后溶液呈蓝色,该实验过程中所发生反应的化学方程式为________.
解析:
|
(1)①有黑色不溶物,溶液呈无色; ②有黑色不溶物,溶液呈蓝色; ③含C、Fe; (3)无,蓝,①有,②
(1)C、CuO、Pe三种物质中,C不与稀硫酸反应,CuO、Fe能与稀硫酸反应,CuO为黑色粉末,与稀硫酸反应会生成蓝色溶液( (2)实验1:将C和CuO在空气中灼烧,会发生如下反应: |

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案(1)小明先对实验做了如下设想和分析.取少量粉末于烧杯中,向烧杯中加入过量的稀硫酸,则实验中可能出现的现象与对应结论如下表所示(表中未列完所有情况).请你帮助完成.
| 烧杯中可能出现的现象 | 结论 |
| ①有黑色不溶物,无气泡逸出,溶液呈无色 | 结论:只含 |
| ② |
结论:含C、CuO |
| ③ |
结论:含C、Fe |
【查阅资料】①Cu、Cu2O都是红色固体;
②2CuO+C
| ||
| ||
③CO+Cu2O
| ||
【猜想】生成的红色粉末究竟是什么?请你和小方一起完成下列猜想:
猜想①Cu; 猜想②Cu2O; 猜想③
【设计实验】小方同学设计了一个简单实验很快排除了猜想①,请你帮助他完成下表:
| 实验步骤 | 现象 | 结论 |
| 猜想①不正确 |
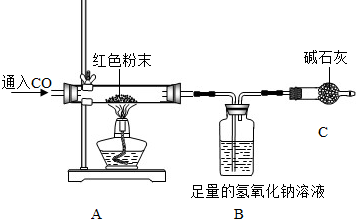
①取红色粉末样品的质量20克; ②测出反应前B装置的总质量为210.0克;
③反应很长时间后测得B装置的总质量为214.4克;④通过计算确定红色粉末的组成.
根据上述实验,回答下列问题:
Ⅰ.实验开始时,先通CO后称量B装置的总质量,再加热,实验目的是
A.排尽装置内空气,防止加热发生爆炸
B.防止装置内的空气影响测量结果
C.防止液体倒流到硬质玻璃管中
Ⅱ.C装置的作用是
Ⅲ.为防止实验中尾气对大气的污染,可以对尾气进行收集,现提供水槽和集气瓶,还需一种仪器是
Ⅳ.请你根据以上数据通过计算,得出红色粉末组成是
Ⅴ.不改变装置和药品,你还可以通过测定
【交流反思】小红认为红色粉中的铜,有一部分可能是C与Cu2O在高温下反应生成的,写出反应的化学方程式:
(1)小明先对实验做了如下设想和分析.取少量粉末于烧杯中,向烧杯中加入过量的稀硫酸,则实验中可能出现的现象与对应结论如下表所示(表中未列完所有情况).请你帮助完成.
| 烧杯中可能出现的现象 | 结论 |
| ①有黑色不溶物,无气泡逸出,溶液呈无色 | 结论:只含______ |
| ②______ | 结论:含C、CuO |
| ③______ | 结论:含C、Fe |
【查阅资料】①Cu、Cu2O都是红色固体;
②2CuO+C
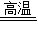 2Cu+CO2↑,4CuO
2Cu+CO2↑,4CuO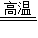 2Cu2O+O2↑
2Cu2O+O2↑③CO+Cu2O
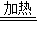 2Cu+CO2,Cu2O+2HCl=CuCl2+Cu+H2O
2Cu+CO2,Cu2O+2HCl=CuCl2+Cu+H2O【猜想】生成的红色粉末究竟是什么?请你和小方一起完成下列猜想:
猜想①Cu; 猜想②Cu2O; 猜想③______.
【设计实验】小方同学设计了一个简单实验很快排除了猜想①,请你帮助他完成下表:
| 实验步骤 | 现象 | 结论 |
| ______ | ______ | 猜想①不正确 |
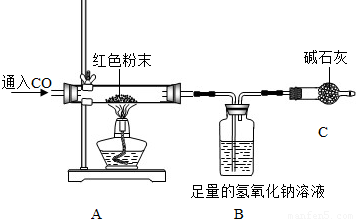
①取红色粉末样品的质量20克; ②测出反应前B装置的总质量为210.0克;
③反应很长时间后测得B装置的总质量为214.4克;④通过计算确定红色粉末的组成.
根据上述实验,回答下列问题:
Ⅰ.实验开始时,先通CO后称量B装置的总质量,再加热,实验目的是______
A.排尽装置内空气,防止加热发生爆炸
B.防止装置内的空气影响测量结果
C.防止液体倒流到硬质玻璃管中
Ⅱ.C装置的作用是______.
Ⅲ.为防止实验中尾气对大气的污染,可以对尾气进行收集,现提供水槽和集气瓶,还需一种仪器是______.
Ⅳ.请你根据以上数据通过计算,得出红色粉末组成是______.
Ⅴ.不改变装置和药品,你还可以通过测定______等数据,再通过计算得出红色粉末组成.
【交流反思】小红认为红色粉中的铜,有一部分可能是C与Cu2O在高温下反应生成的,写出反应的化学方程式:______ 4Cu+CO2↑
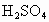 ,③
,③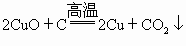 ,
,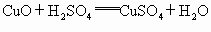
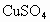 ).铁粉也是黑色粉末,与稀硫酸反应产生大量气泡,生成浅绿色溶液(
).铁粉也是黑色粉末,与稀硫酸反应产生大量气泡,生成浅绿色溶液(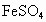 ).根据表格中结论:如黑色粉末为C,则加入过量稀硫酸不反应,黑色固体不溶解,溶液呈无色;如果黑色粉末为C和CuO的混合物加入足量的稀硫酸,有黑色不溶物,同时溶液变为蓝色;根据表格中的现象:有黑色不溶物为C,有气泡逸出,溶液呈浅绿色,可断定黑色粉末中还含Fe.
).根据表格中结论:如黑色粉末为C,则加入过量稀硫酸不反应,黑色固体不溶解,溶液呈无色;如果黑色粉末为C和CuO的混合物加入足量的稀硫酸,有黑色不溶物,同时溶液变为蓝色;根据表格中的现象:有黑色不溶物为C,有气泡逸出,溶液呈浅绿色,可断定黑色粉末中还含Fe.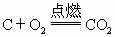 ,灼烧完全后剩余固体为CuO,加入过量的稀硫酸会被完全溶解,无不溶物存在,得到蓝色
,灼烧完全后剩余固体为CuO,加入过量的稀硫酸会被完全溶解,无不溶物存在,得到蓝色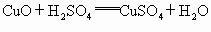 .
.