题目内容
【题目】如图所示为实验室中常见的气体制备、干燥、收集和性质实验的部分仪器. 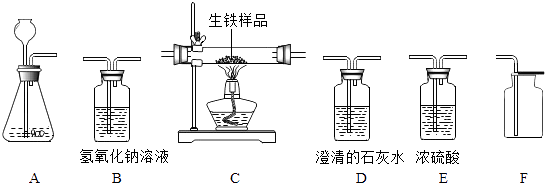
试根据题目要求,回答下列问题:(设过程中所有发生的反应都恰好完全进行).
(1)若要制备干燥的二氧化碳气体 ①仪器的连接顺序为 .
②装置A中所发生反应的化学方程式为 .
③叙述检查装置A气密性的操作方法
(2)生铁和钢都是铁的重要合金.某化学研究小组的同学要利用过氧化氢溶液和二氧化锰制备干燥、纯净的氧气并证明某生铁样品中含有碳元素并测定其含碳量,仪器连接顺序为:A→E→C→D1→B→D2 . (已知D1、D2为2个澄清石灰水洗气瓶) ①其中装置E的作用是
②仪器D1中的现象是 .
③请写出装置B中所发生反应的化学方程式 .
④现取Wg该生铁样品在纯氧中燃烧,当整套装置内的化学反应均完全进行后,经测量仪器D1增重m1g,仪器B增重m2g,仪器D2质量没有变化,则该试样中含碳元素的质量为克(计算结果可为分数形式).
【答案】
(1)AEF;CaCO3+2HCl=CaCl2+H2O+CO2↑;用弹簧夹夹住右边导管,向长颈漏斗中倒水,液面高度不变,说明装置气密性良好(合理均可)
(2)吸收氧气中的水蒸气(或干燥氧气);澄清石灰水变浑浊;CO2+2NaOH=Na2CO3+H2O;![]()
【解析】解:(1)①实验室通常用稀盐酸与大理石反应制取二氧化碳,反应物的状态是固态和液态,反应条件是常温,应选固﹣液不加热型的发生装置;二氧化碳的密度比空气大,能溶于水,只能用排水法收集;因为要收集到干燥的二氧化碳,所以应在收集装置前面加一个干燥装置,浓硫酸具有吸水性,可用来干燥二氧化碳,所以仪器的连接顺序为:A→E→F;②碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑;③检查A装置气密性可用弹簧夹夹住右边导管,向长颈漏斗中倒水,液面高度不变,说明装置气密性良好,也可将右边导管伸入水中,然后两手紧握锥形瓶,若导管口有气泡冒出,说明装置气密性良好;(2)①浓硫酸具有吸水性,可以吸收氧气中的水蒸汽;②生铁中的碳和氧气反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;③二氧化碳和氢氧化钠反应生成碳酸钠和水,方程式是CO2+2NaOH=Na2CO3+H2O;④仪器D1增重m1g,仪器B增重m2g,仪器D2质量没有变化,说明生铁中的碳燃烧生成的二氧化碳被仪器D1、仪器B完全吸收,二氧化碳中碳元素的质量=(m1g+m2g)× ![]() ×100%=
×100%= ![]() g; 所以答案是:(1)①AEF;②CaCO3+2HCl═CaCl2+H2O+CO2↑;③用弹簧夹夹住右边导管,向长颈漏斗中倒水,液面高度不变,说明装置气密性良好(合理均可);(2)①吸收氧气中的水蒸气(或干燥氧气);②澄清石灰水变浑浊;③CO2+2NaOH=Na2CO3+H2O;④
g; 所以答案是:(1)①AEF;②CaCO3+2HCl═CaCl2+H2O+CO2↑;③用弹簧夹夹住右边导管,向长颈漏斗中倒水,液面高度不变,说明装置气密性良好(合理均可);(2)①吸收氧气中的水蒸气(或干燥氧气);②澄清石灰水变浑浊;③CO2+2NaOH=Na2CO3+H2O;④ ![]() .
.