题目内容
【题目】用不纯的锌片(杂质不参加反应)与稀硫酸反应,六次实验结果记录如下:(计算结果均取整数)

次数 | 1 | 2 | 3 | 4 | 5 | 6 |
加入锌的质量(g) | 2 | 4 | 6 | 8 | 10 | 12 |
稀硫酸的质量(g) | 60 | 60 | 60 | 60 | 60 | 60 |
生成的硫酸锌的质量(g) | 5 | 15 | 17 | 17 |
(1)将第2次和第5次实验产生的硫酸锌的质量填在上表中;
(2)在右图中画出硫酸锌与锌的质量函数关系的曲线;
(3)若将(10+m)g这种锌片放入60g这种稀硫酸中,充分反应后剩余固体的质量为 g;
(4)该实验所使用的稀硫酸中溶质的质量分数为 .
【答案】(1)10,17;(2)
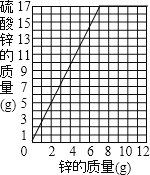 ;
;
(3)3+m;(4)l7%.
【解析】(1)根据第一组实验数据可知,加入2克锌和硫酸反应生成硫酸锌的质量为5克;第二组:加入4克锌和硫酸生成硫酸锌的质量=5克×2═10克;第三组:加入8克锌和硫酸反应应生成硫酸锌的质量=5克×4═20克,但是题目中硫酸锌的质量为17克,所以60克硫酸全部参加反应,锌有剩余,第四组:由于第三组中硫酸已经完全反应,所以硫酸锌的质量不变,即硫酸锌的质量为17克;
(2)设生成17g硫酸锌时,反应掉的锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 161
x 17g
![]() x≈7g
x≈7g
(3)第4次实验硫酸完全反应,当第5次实验中金属锌的质量增加时,硫酸已消耗完毕,当硫酸反应完全时反应掉的锌的质量为7g,多余的锌均剩余,若使(10+m)g锌与60g稀硫酸充分反应后,剩余固体质量为(10+m)g﹣7g=(m+3)g;
(4)设生成17g硫酸锌时消耗硫酸的质量为y
Zn+H2SO4═ZnSO4+H2↑
98 161
y 17g
![]() y≈10
y≈10
稀硫酸的溶质的质量分数为:![]() ≈17%
≈17%
答:稀硫酸的质量分数为17%.

练习册系列答案
相关题目
