题目内容
为测定某大理石样品中碳酸钙的含量,某化学兴趣小组称取10.0g该大理石样品,加入足量的稀盐酸,完全反应后称得剩余固体质量是2.0g.样品中的杂质不参加反应,也不溶于水.请回答下列问题(结果精确到0.1g)
(1)该样品中碳酸钙的质量为 g;
(2)计算该小组可制得的二氧化碳的质量,写出必要的计算过程.
(1)该样品中碳酸钙的质量为
(2)计算该小组可制得的二氧化碳的质量,写出必要的计算过程.
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)样品中杂质不溶于水且不与稀盐酸反应,所以加入足量稀盐酸完全反应后固体剩余物的质量2g即是杂质的质量,碳酸钙的质量=10g-2g=8g;
(2)据碳酸钙的质量结合方程式计算二氧化碳的质量.
(2)据碳酸钙的质量结合方程式计算二氧化碳的质量.
解答:解:(1)样品中杂质不溶于水且不与稀盐酸反应,所以加入足量稀盐酸完全反应后固体剩余物的质量2g即是杂质的质量,碳酸钙的质量=10g-2g=8g;
(2)设10g该样品最多可以制得二氧化碳的质量的为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
8g x
=
x=3.52g
故答案为:(1)8g;(2)该样品最多可以制得二氧化碳3.52g.
(2)设10g该样品最多可以制得二氧化碳的质量的为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
8g x
| 100 |
| 8g |
| 44 |
| x |
x=3.52g
故答案为:(1)8g;(2)该样品最多可以制得二氧化碳3.52g.
点评:本题难度不是很大,主要考查了学生分析题意获取选项及根据化学方程式进行有关的计算,培养学生分析问题的能力和解决问题的能力.

练习册系列答案
相关题目

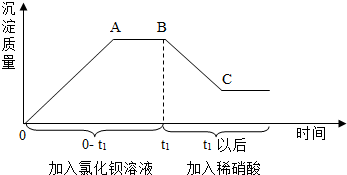 某溶液中可能含有碳酸钠、硫酸钠、氯化钠、硝酸钠中的一种或几种,为测定其成分,进行如下实验.取样,先后逐滴加入氯化钡溶液、稀硝酸,产生沉淀的质量与时间的关系如图所示.
某溶液中可能含有碳酸钠、硫酸钠、氯化钠、硝酸钠中的一种或几种,为测定其成分,进行如下实验.取样,先后逐滴加入氯化钡溶液、稀硝酸,产生沉淀的质量与时间的关系如图所示.