题目内容
【题目】把4g硫粉放在给定质量的氧气中燃烧,有关实验数据如下表所示,请回答问题:
第一次 | 第二次 | 第三次 | |
氧气的质量(g) | 3 | 4 | 6 |
二氧化硫的质量(g) | 6 |
(1)第一次实验中参加反应的S的质量,O2的质量与生成SO2的质量比是___________。
(2)请你通过计算求出第二次.第三次实验生成的SO2的质量,填入表中。___________、___________
【答案】1:1:2 8 8
【解析】
本题考查的是根据化学反应方程式的计算,根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和。
(1)由图表数据可知,第一次参加反应的S的质量=生成的SO2的质量-O2的质量,所以第一次参加反应的S的质量=6g-3g=3g;所以第一次实验中,参加反应的S、O2、生成的SO2三种物质的质量比为:3g:3g:6g=1:1:2;
(2)设第二次实验中,参加反应的S的质量为x,
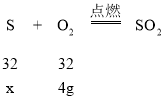
32/32 =x/4g
x=4g
则第二次实验生成SO2的质量为:4g+4g=8g;因为只有4g硫粉,由第二次实验的计算可知,4g硫粉与给定质量的氧气完全反应,生成8gSO2,故第三次实验生成SO2的质量应为8g。

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
【题目】下列说法完全正确的是( )
A | 氖气的化学式—— 1个硅原子—— 1个钠离子--- | B | 决定元素种类——质子数 决定元素化学性质——最外层电子数 决定元素在周期表中的周期序数——电子层数 |
C | 铁——由分子构成 二氧化碳——由原子构成 硫酸铜——由离子构成 | D | 分子——化学变化中的最小粒子 原子——保持物质化学性质的最小粒子 离子——带电的原子或原子团 |
A. AB. BC. CD. D