题目内容
下列物质溶于水后,得到的溶液的pH>7的是( )
A.氢氧化钙 B.二氧化碳
C.氯化钠 D.盐酸
【答案】
A
【解析】试题分析:可以根据物质的酸碱性进行判断,氢氧化钙呈碱性,二氧化碳能与水反应生成碳酸,碳酸呈酸性;氯化钠的水溶液呈中性,盐酸呈酸性。
A、氢氧化钙溶于水,溶液显碱性,pH>7;
B、二氧化碳溶于水,和水反应生成碳酸,碳酸显酸性,pH<7;
C、氯化钠溶于水,溶液显中性,pH=7;
D、盐酸溶于水,溶液显酸性,pH<7。故选A
考点:本题考查溶液的酸碱性与pH值的关系
点评:解答本题要掌握溶液的酸碱性和溶液pH大小之间的关系,然后再根据具体物质的水溶液的酸碱性进行分析、判断,从而得出正确的结论。

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
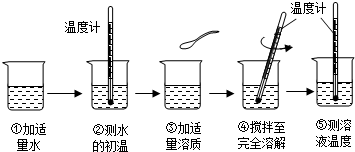
(6分)浩然同学以“物质溶于水后液体的温度是否改变?”为课题进行探究,其用品和操作示意图如表:
| 实验目的 | 探究下列物质溶解前后液体温度变化情况 |
| 实验用品 | 药匙、烧杯、玻璃棒、温度计、水、氢氧化钠、氯化钠、硝酸铵 |
| 操作过程 | 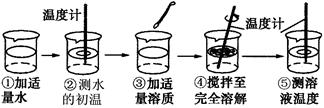 |
(1)“搅拌”的目的是 。图示④中的操作存在一处错误,应改正为 。
(2)三只烧杯中溶液的温度高于20℃的是 溶液,这是因为 。
(3)溶解硝酸铵固体的烧杯外壁有水珠产生,其原因是 。
(4)由此探究实验可知 溶于水温度没有明显的变化。
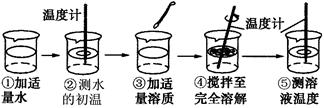
(6分)浩然同学以“物质溶于水后液体的温度是否改变?”为课题进行探究,其用品和操作示意图如表:
|
实验目的 |
探究下列物质溶解前后液体温度变化情况 |
|
实验用品 |
药匙、烧杯、玻璃棒、温度计、水、氢氧化钠、氯化钠、硝酸铵 |
|
操作过程 |
|
他取三只烧杯,向烧杯中各注入25ml水,测得水的初温为20℃。再向三只烧杯中分别加入质量均为8g的氢氧化钠、氯化钠、硝酸铵固体,搅拌,待溶解后用温度计分别测三只烧杯中溶液的温度。
(1)“搅拌”的目的是 。图示④中的操作存在一处错误,应改正为 。
(2)三只烧杯中溶液的温度高于20℃的是 溶液,这是因为 。
(3)溶解硝酸铵固体的烧杯外壁有水珠产生,其原因是 。
(4)由此探究实验可知 溶于水温度没有明显的变化。
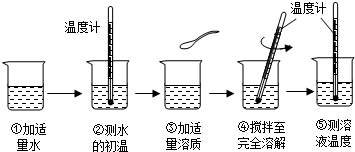
浩然同学以“物质溶于水后液体的温度是否改变?”为课题进行探究,其用品和操作示意图如下表:
| 实验目的 | 探究下列物质溶解前后液体温度变化情况 |
| 实验用品 | 药匙、烧杯、玻璃棒、温度计、水、氢氧化钠、氯化钠、硝酸铵 |
| 操作过程 | 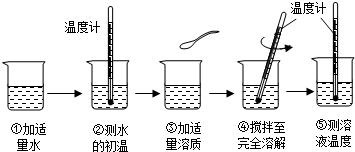 |
(1)“搅拌”的目的是______.图示④中的操作存在一处错误,应改正为______.
(2)三只烧杯中溶液的温度高于20℃的是______溶液,这是因为______.
(3)溶解硝酸铵固体的烧杯外壁有水珠产生,其原因是______.
(4)由此探究实验可知______溶于水温度没有明显的变化.