题目内容
【题目】我国每年报废的手机超过1亿部。废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。化学兴趣小组为回收其中的铜,设计并进行了如图实验。已知:Cu+H2O2+H2SO4=CuSO4+2H2O;不考虑金、银发生类似反应。
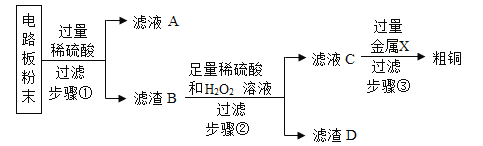
(1)将电路板粉碎成粉末的目的是_____。
(2)写出一个步骤①中发生反应的化学方程式_____。
(3)滤液A中的阳离子有_____。
(4)步骤②的目的是_____。
(5)要除去粗铜中的杂质,不能选用_____。(选填字母序号)
A 氯化铜溶液 B 稀盐酸 C 蒸馏水
【答案】增大接触面积,使反应充分,加快反应速率 Fe+H2SO4=FeSO4+H2↑ Al3+、Fe2+、H+ 将铜单质全部转化为Cu2+ C
【解析】
(1)将电路板粉碎成粉末的目的是增大接触面积,使反应充分,加快反应速率。
(2)金属活动性顺序中,氢前的金属能与稀硫酸反应,铝、铁、铜、银、金中的铝、铁可与稀硫酸反应,2Al+3H2SO4=Al2(SO4)3+3H2↑或Fe+H2SO4=FeSO4+H2↑。
(3)铝、铁、铜、银、金中的铝、铁可与稀硫酸反应,生成Al3+、Fe2+,因为加入过量的稀硫酸,所以第一次过滤后的滤液中的阳离子有Al3+、Fe2+、H+。
(4)因为Cu+H2O2+H2SO4=CuSO4+2H2O,所以步骤②的目的是将铜单质全部转化为Cu2+。
(5)步骤③的滤液中含有H2SO4、CuSO4,加入过量的铁粉,Fe+H2SO4=FeSO4+H2↑、Fe+CuSO4=Cu+FeSO4 ,所以粗铜中的杂质是铁。A 氯化铜溶液能将铁除去,Fe+CuCl2 = Cu+FeCl2,此选项不符合题意;B 稀盐酸能将铁除去,Fe+2HCl=FeCl2+H2↑,此选项不符合题意;C 铁不溶于蒸馏水,也不与蒸馏水反应,此选项符合题意。故选C。

 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
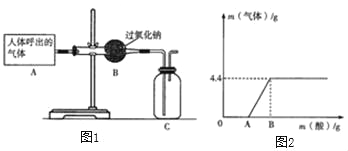
小学课时作业全通练案系列答案【题目】硫酸铜对过氧化氢的分解也有催化作用。取一定质量8.5%的过氧化氢溶液 倒入烧杯中,加入一定质量15%的硫酸铜溶液,过氧化氢完全分解。有关实验数据如表所示(不考虑气体在水中的溶解)。请计算:
(1)生成氧气的质量为___g;
反应前 | 反应后 | ||
实验数据 | 烧杯和过氧化氢溶液的质量∕g | 硫酸铜溶液的质量∕g | 烧杯和烧杯中溶液的质量∕g |
60 | 3.3 | 62.5 | |
(2)过氧化氢溶液的质量_________。
【题目】在中考化学实验操作考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如图所示的实验.
(1)写出试管②中碳酸钠与澄清石灰水反应的化学方程式: _______ .
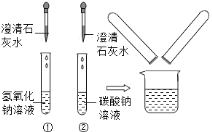
(2)实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.
(提出问题)滤液中除水外还含有哪些物质?
(猜想)小红认为:只含氢氧化钠;
小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:可能含有氢氧化钠和碳酸钠;
你认为:可能含有氢氧化钠和_______. (写一种猜想).
(讨论)你认为小红、小明、小亮三位同学中谁的猜想不合理,请说明理由_____________.
(实验设计)设计一个简单的实验证明你的猜想正确.
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,___ | ___________ | 你的猜想正确 |
(反思拓展)
①在分析化学反应后所得溶液中溶质的成分时,除考虑生成物外还需考虑_____.
②通过以上探究,你认为应怎样处理上述实验后的废液才能倒入下水道?_______.