题目内容
【题目】某混合气体由H2、N2、CO和CH4中的两种组成,将该混合气体点燃后,得到的气体产物依次通过浓H2SO4和NaOH溶液,结果两溶液的质量均有增加.则该混合气体的组成不可能是
A. H2和CH4 B. CO和CH4
C. N2和CO D. H2和CO
【答案】C
【解析】浓硫酸质量增加说明吸收了水分,说明混合气中有氢元素;氢氧化钠质量增加,说明吸收了二氧化碳,说明混合气中有碳元素,也就是说混合气中必须含有碳、氢元素,
A、含有碳、氢元素,故A正确;
B、含有碳氢元素,故B正确;
C、不含氢元素,故C错误;
D、含有碳、氢元素,故D正确.
故选C

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验室中有一瓶含有少量氯化钠和可溶性杂质的硫酸钠样品.某化学兴趣小组对该样品成分进行定量测定,甲、乙、丙三位同学分别称取一定质量的样品放入烧杯中,溶入足量水后过滤得到滤液;再向滤液中加入一定质量的氯化钡溶液,充分反应后过滤,将沉淀洗涤、干燥并称量.相关实验数据记录如下:(Na2SO4+BaCl2=BaSO4↓+2NaCl)
称量项目 | 甲 | 乙 | 丙 |
所取样品的质量/g | 15 | 15 | 20 |
加入氯化钡溶液的质量/g | 150 | 100 | 100 |
反应后所得沉淀的质量/g | 23.3 | 23.3 | 23.3 |
请回答下列问题:
(1)__________同学(选填“甲”“乙”或“丙”)所取用的样品与氯化钡溶液恰好完全反应.
(2)计算该样品中硫酸钠的质量分数.(写出计算步骤,计算结果保留到0.1%)
(3)若欲计算出样品与氯化钡溶液恰好完全反应时所得溶液的溶质质量分数,上述实验过程中还需要测定的数据是__________.
【题目】实验室有两瓶标签破损的无色溶液甲、乙,只知道它们分别是稀盐酸和氢氧化钠溶液。请同学设计不同方案区别它们。按要求回答下列问题:
(1)在不选用酸碱指示剂、pH试纸的情况下,选择不同类别的物质进行区分。
所加试剂 | 实验现象和结论 | 发生反应的化学方程式 | |
方法一 | 锌粒 | 有气泡产生的是稀盐酸,无气泡产生的是氢氧化钠溶液 | Zn+2HCl=ZnCl2+H2↑ |
方法二 |
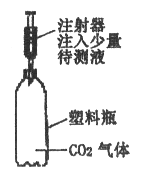
(2)同学们在交流实验方案时,小刚设计的“用二氧化碳气体做试剂”引起了一场争论。正方观点:可以区别;反方观点:无法区别。小明赞同反方的观点,其理由是_______________;小红则赞同正方的观点,如果你也赞同的话,请你参考下图装置说出验证的方法(简要写出操作、现象、结论):__________________。