题目内容
将稀盐酸、Na2CO3溶液、Ca(OH)2溶液倒入同一烧杯中,充分反应后过滤,得到固体A和滤液B.
(1)得到的固体A是 ;
(2)探究滤液B中是否含有Na2CO3:取少量滤液B滴加足量稀盐酸,始终没有气泡冒出.由此得出结论: ;
(3)探究滤液B中是否含有CaCl2:取少量滤液B滴加足量Na2CO3溶液,没有沉淀出现.由此得出结论:不含有CaCl2.这一探究同时说明滤液B中也不含有Ca(OH)2;
(4)综合分析可知:滤液B中一定含有的溶质是 ;可能含有的溶质是 .
(1)得到的固体A是
(2)探究滤液B中是否含有Na2CO3:取少量滤液B滴加足量稀盐酸,始终没有气泡冒出.由此得出结论:
(3)探究滤液B中是否含有CaCl2:取少量滤液B滴加足量Na2CO3溶液,没有沉淀出现.由此得出结论:不含有CaCl2.这一探究同时说明滤液B中也不含有Ca(OH)2;
(4)综合分析可知:滤液B中一定含有的溶质是
考点:酸的化学性质,碱的化学性质,盐的化学性质
专题:常见的酸 酸的通性,常见的碱 碱的通性,常见的盐 化学肥料
分析:(1)A是CaCO3,这个实验只能得到这个沉淀;
(2)加入足量稀盐酸都没有气泡那么溶液中必然没有碳酸根;
(4)综合分析(如果不含有氯化钙成立)那么溶液中必定含有氯化钠,可能含有氢氧化钠
(2)加入足量稀盐酸都没有气泡那么溶液中必然没有碳酸根;
(4)综合分析(如果不含有氯化钙成立)那么溶液中必定含有氯化钠,可能含有氢氧化钠
解答:解:(1)将稀盐酸、Na2CO3溶液、Ca(OH)2溶液倒入同一烧杯中,他们要相互反应:2HCl+Na2CO3=2NaCl+H2O+CO2↑、2HCl+Ca(OH)2=CaCl2+2H2O、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,只能得到CaCO3沉淀;
(2)加入足量稀盐酸都没有气泡那么溶液中必然没有碳酸根,由此得出结论滤液B中不含有Na2CO3;
(3)探究B是否含有CaCl2,氯离子不参与离子反应,故B中必然含有氯离子,而氢氧根就不一定,因为盐酸的量可能不足,也可能过量,所以当加入碳酸钠而无沉淀时,说明在溶液中一定没有钙离子,所以既不会含有氯化钙,也不可能含有氢氧化钙.
(4)综合分析滤液中不含有氯化钙和氢氧化钙,那么溶液中必定含有氯化钠,也可能含有氢氧化钠.
故答案为:(1)CaCO3;
(2)滤液B中不含有Na2CO3;
(4)NaCl;NaOH.
(2)加入足量稀盐酸都没有气泡那么溶液中必然没有碳酸根,由此得出结论滤液B中不含有Na2CO3;
(3)探究B是否含有CaCl2,氯离子不参与离子反应,故B中必然含有氯离子,而氢氧根就不一定,因为盐酸的量可能不足,也可能过量,所以当加入碳酸钠而无沉淀时,说明在溶液中一定没有钙离子,所以既不会含有氯化钙,也不可能含有氢氧化钙.
(4)综合分析滤液中不含有氯化钙和氢氧化钙,那么溶液中必定含有氯化钠,也可能含有氢氧化钠.
故答案为:(1)CaCO3;
(2)滤液B中不含有Na2CO3;
(4)NaCl;NaOH.
点评:本题主要考查酸碱盐之间的相互反应,难度比较大.熟练掌握它们之间的反应后生成物以及存在状态,碳酸根离子、钙离子的检验方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法中错误的是( )
| A、人呼出的气体中水蒸气的含量比空气中水蒸气的含量大 |
| B、绿色化学的核心是利用化学原理从源头消除污染 |
| C、铁生锈包含缓慢氧化反应 |
| D、将带火星的木条放入集气瓶内,木条复燃,证明收集满了 |
 盐酸.为区别这三种溶液,在老师指导下,兴趣小组的同学把这三种溶液按A、B、C进行编号,然后分别各取适量作为样品加入到三支试管中,进行了如图所示的探究活动:
盐酸.为区别这三种溶液,在老师指导下,兴趣小组的同学把这三种溶液按A、B、C进行编号,然后分别各取适量作为样品加入到三支试管中,进行了如图所示的探究活动: 如图为实验室用加热高锰酸钾的方法制取氧气的装置图,回答问题:
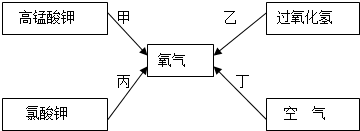
如图为实验室用加热高锰酸钾的方法制取氧气的装置图,回答问题: