题目内容
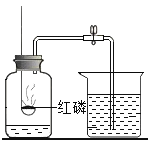
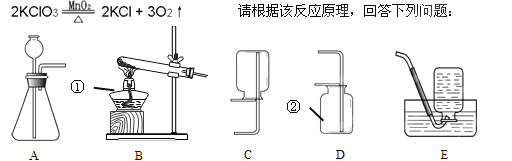
【题目】有一包固体粉末。可能含有铜、氧化铁、氯化钠、硫酸钠、硫酸铜中的一种或几种。为了确定其成分进行如下实验,现象如图所示(部分生成物未标出,假设每步反应都恰好完全)。
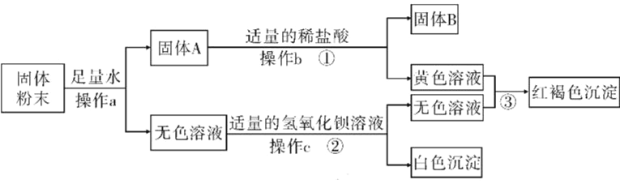
根据实验过程中的现象判断:
(1)红褐色固体的成分是________(填化学式);a、b、c含同一操作,其名称是________。
(2)写出反应①的化学方程式________。
(3)原固体粉末的成分可能有________种情况。
【答案】Fe(OH)3; 过滤 Fe2O3+6HCI=2FeCl3+3H2O 2(两)
【解析】
固体粉末加水溶解得固体A和无色溶液,说明一定不含溶液呈蓝色的硫酸铜,固体A中加盐酸,得黄色溶液和固体B,说明一定有氧化铁和铜,无色溶液中加氢氧化钡溶液得无色溶液和白色沉淀,说明一定含有硫酸钠;
(1)红褐色固体的成分是氢氧化铁,化学式为 Fe(OH)3 ;a、b、c含过滤操作;
(2) 反应① 为氧化铁与稀盐酸的反应,方程式为 Fe2O3+6HCI=2FeCl3+3H2O ;
(3)因无法验证是否有氯化钠,所以 原固体粉末的成分有2种情况。

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】碳及碳的化合物与我们的生活密切相关。
(1)填写有关含碳物质的对应特性。
物质用途 | 金刚石切割玻璃 | 石墨作电极 | 活性炭净水 | 一氧化碳冶炼金属 |
对应特性 | ①___ | ②___ | ③___ | ④___ |
(2)液态二氧化碳灭火器用于扑救档案资料室发生的火灾,说法正确的有___(填标号)。
A 液态二氧化碳气化后不会污染档案资料
B 二氧化碳可覆盖在燃烧物表面,隔绝空气
C 液态二氧化碳气化时吸热,降低了可燃物的着火点
(3)过多的二氧化碳导致的环境问题是___,写出一条减少二氧化碳排放的建议___。
(4)二氧化碳是一种宝贵的资源。在高温高压下,CO2和NH3可以合成尿素[CO(NH2)2],同时生成水。该反应的化学方程式为___。
(5)目前,人类以化石燃料为主要能源。化石燃料有煤、___和天然气,它们都属于___(填“可再生”或“不可再生”)能源,天然气中甲烷完全燃烧的化学方程式为___。
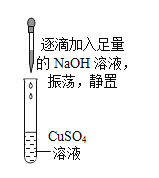
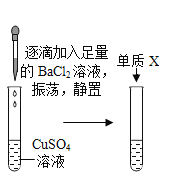
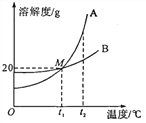
【题目】兴趣小组对硫酸铜溶液进行相关实验。
实验步骤 | 实验现象 | 回答问题 | |
实验一 |
|
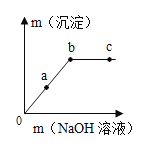
| (1)该反应的化学方程式___。 (2)a点时,溶液的溶质是___。 (3)b点的意义是___。 (4)c点时,观察到的现象是___。 |
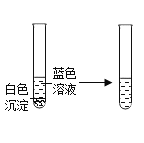
实验二 |
|
| (1)从溶液颜色判断加入BaCl2溶液的量___。 A 过量 B 少量 C 无法判断 (2)将反应后溶液由蓝色转变成其他颜色,可加入的固体单质X是___。 |
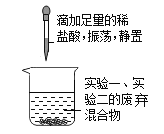
实验三 |
|
| 沉淀的化学式是___。 |