题目内容
(1)汽车进入家庭已成为现代社会的普遍现象.
①制造汽车需要大量钢铁,以冶炼赤铁矿石为例,用化学方程式表示工业上炼铁的原理______.
②汽车表面喷漆可以延缓钢板锈蚀,其防锈原理是隔绝空气中的______和______.
③给汽车喷漆前需将铁制品放入稀盐酸中除锈(铁锈主要成分是Fe2O3).其反应的化学方程式是______.
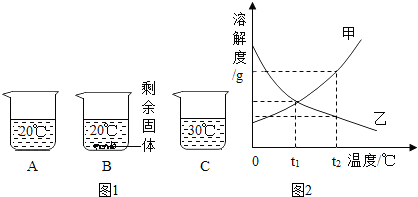
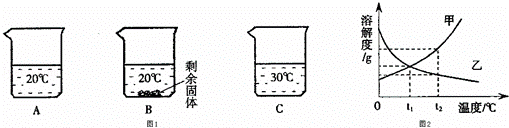
(2)向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图1所示.

①烧杯中的溶液一定属于饱和溶液的是______(填字母序号,下同)
②图2能表示NaNO3溶解度曲线的是______(填“甲”或“乙”);
③由图2分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的______(填序号).
A.甲、乙都是饱和溶液 B.溶液质量:甲>乙 C.溶质质量分数:甲>乙.
解:(1)①一氧化碳和氧化铁反应生成铁和二氧化碳,化学方程式为3CO+Fe2O3 2Fe+3CO2;
2Fe+3CO2;
②铁生锈的条件是与空气中氧气和水同时接触,所以汽车表面喷漆可以延缓钢板锈蚀,其防锈原理是隔绝空气中的氧气和水;
③稀盐酸和氧化铁反应生成氯化铁和水,化学方程式为Fe2O3+6 HCl=2FeCl3+3H2O;
(2)①由图1可知:20℃时向A烧杯中加入10g完全溶解,可能是饱和溶液;B烧杯中加入25g有剩余固体,一定属于饱和溶液;30℃加入25g全部溶解,可能是饱和溶液;
②由图1可知,随着温度的升高溶解的硝酸钠的质量逐渐增加,所以在图2中,能表示NaNO3溶解度曲线的是甲;
③A、乙的溶解度随温度降低逐渐增大,故降低温度变为不饱和溶液,故A错误;
B、分别将100g甲、乙的饱和溶液从 t2℃降温到 t1℃,甲有溶质析出,溶液的质量甲<乙,故B错误;
C、等质量的甲、乙饱和溶液从 t2℃降温至 t1℃时,甲析出溶质,乙由于溶解度增大而无晶体析出.降低到 t1℃时,溶解度是甲=乙,但由于乙不是饱和溶液,所以其溶质的质量分数是甲>乙,故C正确.
故答案为:(1)①3CO+Fe2O3 2Fe+3CO2;②氧气;水; ③Fe2O3+6 HCl=2FeCl3+3H2O;
2Fe+3CO2;②氧气;水; ③Fe2O3+6 HCl=2FeCl3+3H2O;
(2)①B;②甲; ③C.
分析:(1)①根据一氧化碳和氧化铁反应生成铁和二氧化碳进行解答;
②根据铁生锈的条件是与空气中氧气和水同时接触进行解答;
③根据稀盐酸和氧化铁反应生成氯化铁和水进行解答;
(2)①根据一定温度下,有剩余固体存在的溶液为饱和溶液进行解答;
②由烧杯中不同温度下溶解的硝酸钠的质量变化分析解答;
③根据甲乙的溶解度曲线随温度变化情况,并结合选项中的问题逐一分析解答.
点评:本题较为综合的考查了化学方程式的书写以及溶解度曲线的理解和应用,以及学生分析题目信息判断饱和溶液的方法,是一道能较好考查学生分析解决问题能力的好题.
 2Fe+3CO2;
2Fe+3CO2;②铁生锈的条件是与空气中氧气和水同时接触,所以汽车表面喷漆可以延缓钢板锈蚀,其防锈原理是隔绝空气中的氧气和水;
③稀盐酸和氧化铁反应生成氯化铁和水,化学方程式为Fe2O3+6 HCl=2FeCl3+3H2O;
(2)①由图1可知:20℃时向A烧杯中加入10g完全溶解,可能是饱和溶液;B烧杯中加入25g有剩余固体,一定属于饱和溶液;30℃加入25g全部溶解,可能是饱和溶液;
②由图1可知,随着温度的升高溶解的硝酸钠的质量逐渐增加,所以在图2中,能表示NaNO3溶解度曲线的是甲;
③A、乙的溶解度随温度降低逐渐增大,故降低温度变为不饱和溶液,故A错误;
B、分别将100g甲、乙的饱和溶液从 t2℃降温到 t1℃,甲有溶质析出,溶液的质量甲<乙,故B错误;
C、等质量的甲、乙饱和溶液从 t2℃降温至 t1℃时,甲析出溶质,乙由于溶解度增大而无晶体析出.降低到 t1℃时,溶解度是甲=乙,但由于乙不是饱和溶液,所以其溶质的质量分数是甲>乙,故C正确.
故答案为:(1)①3CO+Fe2O3
 2Fe+3CO2;②氧气;水; ③Fe2O3+6 HCl=2FeCl3+3H2O;
2Fe+3CO2;②氧气;水; ③Fe2O3+6 HCl=2FeCl3+3H2O;(2)①B;②甲; ③C.
分析:(1)①根据一氧化碳和氧化铁反应生成铁和二氧化碳进行解答;
②根据铁生锈的条件是与空气中氧气和水同时接触进行解答;
③根据稀盐酸和氧化铁反应生成氯化铁和水进行解答;
(2)①根据一定温度下,有剩余固体存在的溶液为饱和溶液进行解答;
②由烧杯中不同温度下溶解的硝酸钠的质量变化分析解答;
③根据甲乙的溶解度曲线随温度变化情况,并结合选项中的问题逐一分析解答.
点评:本题较为综合的考查了化学方程式的书写以及溶解度曲线的理解和应用,以及学生分析题目信息判断饱和溶液的方法,是一道能较好考查学生分析解决问题能力的好题.

练习册系列答案
相关题目