题目内容
【题目】以石灰石矿粉(含有少量Fe2O3及不溶性杂质)为原料生产无水氯化钙的过程如下:
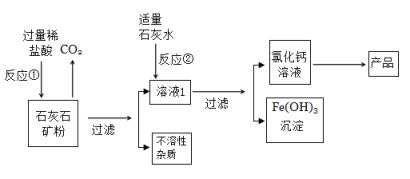
回答下列问题:
(1)过滤需要用到的玻璃仪器有烧杯、玻璃棒及__________。
(2)反应①中加入过量稀盐酸的目的是______________,生产氯化钙的化学方程式为____________________________,溶液1中溶质除了有氯化氢和氯化钙以外,还有________(写化学式)。
(3)反应②中生成Fe(OH)3的反应属于_________________(填基本反应类型),可否用NaOH溶液代替石灰水?________,理由是______________
(4)石灰石矿粉还可以用于______________________。
【答案】漏斗 将石灰石矿粉完全反应 CaCO3 +2HCl =CaCl2 +H2O +CO2↑ FeCl3 复分解反应 不可以 避免引入NaCl杂质 建筑材料
【解析】
(1)过滤需要用到的玻璃仪器有烧杯、玻璃棒及漏斗。
(2)反应①中加入过量稀盐酸的目的是将石灰石矿粉完全反应;石灰石矿粉主要成分为碳酸钙,碳酸钙和稀盐酸反应生成氯化钙沉淀、水和二氧化碳,化学反应方程式为:CaCO3 +2HCl =CaCl2 +H2O +CO2↑;由于石灰石矿粉(含有少量Fe2O3及不溶性杂质),氧化铁和稀盐酸反应生成氯化铁和水,经过过滤,溶液1中溶质有氯化氢、氯化钙和氯化铁。
(3)氯化铁和石灰水反应生成氢氧化铁沉淀和氯化钙,该反应为由两种化合物互相交换成分,生成另外两种化合物的反应,符合复分解反应;不能用氢氧化钠代替石灰水,因为氢氧化钠和氯化铁反应生成氢氧化铁沉淀和氯化钠,除去氯化铁的同时引入了氯化钠新的杂质。
(4)石灰石矿粉主要成分为碳酸钙,还可以用作建筑材料。