题目内容
【题目】石灰石是常用的建筑材料。
①甲乙同学设计了如下实验方案进行探究:
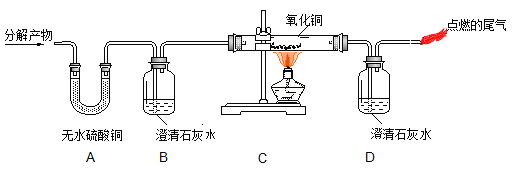
Ⅰ.甲同学取石灰石按图所示进行实验(煤气灯能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,由此甲同学认为石灰石已分解。甲同学结论不合理的理由是 。
写出石灰水变浑浊的化学方程式 。
Ⅱ.乙同学进行如下实验,完成下表
实验步骤 | 实验现象 | 实验结论 |
取少量煅烧后固体于试管中,加水振荡,过滤,取滤液,滴加 溶液 | 溶液变红 | 证明固体中 含有 |
取滤渣滴加足量的稀盐酸 | 含有碳酸钙 |
②为了测定石灰石中碳酸钙的质量分数(假设杂质不参加反应),乙同学设计称取石灰石样品100g,高温煅烧至质量不再改变。实验中固体的质量变化如下:

Ⅰ.生成二氧化碳的质量是 g。
Ⅱ.求石灰石中碳酸钙的质量分数。(根据化学方程式列式计算)
【答案】①I.一氧化碳燃烧也能产生二氧化碳,使石灰水变浑浊的二氧化碳不一定来自于石灰石分解
CO2+Ca(OH)2→CaCO3↓+H2O
II.酚酞 有气泡 氧化钙
②I.33 75%
【解析】
试题分析:石灰石按图所示进行实验(煤气灯能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,由此认为石灰石已分解,是错误的,结论不合理的理由是一氧化碳燃烧也能产生二氧化碳,使石灰水变浑浊的二氧化碳不一定来自于石灰石分解,石灰水变浑浊的化学方程式CO2+Ca(OH)2→CaCO3↓+H2O;取少量煅烧后固体于试管中,加水振荡,过滤,取滤液,滴加酚酞溶液,溶液变红,证明固体中含有氧化钙,取滤渣滴加足量的稀盐酸,如果会有气泡产生,说明含有碳酸钙,根据质量守恒定律知道生产二氧化碳的质量=100克-67克=33克,解:设CaCO3的物质的量为xmol,nco2=(100-67)/44=0.75 mol
CaCO3 高温 CaO + CO2↑
1 1
X 0.75
列比例式得:1:X=1:0.75
解得x=0.75mol
0.75×100 /100= 75%

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案