题目内容
(2006?普宁市二模)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取,主要步骤之一为:

(1)为了使MgCl2转化为Mg(OH)2,试剂①可以选用
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的操作方法是
(3)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出该反应的化学方程式:

(1)为了使MgCl2转化为Mg(OH)2,试剂①可以选用
氢氧化钠溶液
氢氧化钠溶液
;要使MgCl2转化为沉淀,加入试剂①的量应过量
过量
;验证MgCl2已完全转化Mg(OH)2沉淀的方法是取滤液滴入NaOH溶液,若无沉淀产生,则已完全转化
取滤液滴入NaOH溶液,若无沉淀产生,则已完全转化
.(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的操作方法是
过滤
过滤
;试剂②可以选用过量的稀盐酸
过量的稀盐酸
.(3)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出该反应的化学方程式:
MgCl2
Mg+Cl2↑
| ||
MgCl2
Mg+Cl2↑
.
| ||
分析:(1)氯化镁转化为氢氧化镁需要加入碱液,验证MgCl2已完全转化为Mg(OH)2的方法是取滤液滴入NaOH溶液是否有沉淀生成;
(2)根据分离不溶于水的固体的方法是过滤进行解答;
(3)氢氧化镁转化成氯化镁一般是采用盐酸进行中和反应;
(4)利用题目所给的信息结合书写化学方程式的原则进行书写;
(2)根据分离不溶于水的固体的方法是过滤进行解答;
(3)氢氧化镁转化成氯化镁一般是采用盐酸进行中和反应;
(4)利用题目所给的信息结合书写化学方程式的原则进行书写;
解答:解:(1)氯化镁转化为氢氧化镁需要加入碱液以提供氢氧根,此处选择过量的氢氧化钠进行反应,目的是让所取海水中的氯化镁全部转化为氢氧化镁沉淀;验证MgCl2已完全转化为Mg(OH)2的方法是取滤液滴入NaOH溶液,若无沉淀产生,则已完全转化.
(2)能分离得到沉淀的操作名称是过滤;
(3)把氢氧化镁转化成氯化镁需加入盐酸进行中和反应.
(4)由题中可知反应产物,再结合化学反应方程式的书写原则书写方程式:MgCl2
Mg+Cl2↑;
故答案为:(1)氢氧化钠溶液;过量;让所取海水中的氯化镁全部转化为氢氧化镁沉淀;取滤液滴入NaOH溶液,若无沉淀产生,则已完全转化;(2)过滤;(3)过量的稀盐酸;(4)MgCl2
Mg+Cl2↑;
(2)能分离得到沉淀的操作名称是过滤;
(3)把氢氧化镁转化成氯化镁需加入盐酸进行中和反应.
(4)由题中可知反应产物,再结合化学反应方程式的书写原则书写方程式:MgCl2
| ||
故答案为:(1)氢氧化钠溶液;过量;让所取海水中的氯化镁全部转化为氢氧化镁沉淀;取滤液滴入NaOH溶液,若无沉淀产生,则已完全转化;(2)过滤;(3)过量的稀盐酸;(4)MgCl2
| ||
点评:此题是对海水中物质的提纯应用的考查,主要是利用了酸碱盐之间的相关反应,解决了物质的相关转化,是复分解反应发生条件的具体应用.

练习册系列答案
相关题目
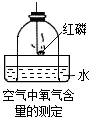 (2006?普宁市二模)如图所示装置可用来测定空气中氧气的含量.
(2006?普宁市二模)如图所示装置可用来测定空气中氧气的含量.