题目内容
【题目】(7分)(1)归纳与比较,是学习化学的重要方法之一,对比CO和CO2,它们的组成元素_____(填“相同”或“不同”,下同),但它们的化学性质________;工业上CO可用来炼铁,请写出反应的化学方程___________,废气不能随意排放,处理方法是____________.
(2)铝具有良好的抗腐蚀性,请用化学方程式解释原因______________.
(3)洗涤剂去油污的原理是:洗涤剂_________;汽油去油污的原理是__________.
【答案】(1) 相同;不同; ;回收再利用;(2)
;回收再利用;(2)![]() ;
;
(3) 具有乳化作用;溶解.
【解析】(1)对比![]() 和
和![]() ,可知它们都由碳元素、氧元素两种元素组成,但它们的化学性质不同,如一氧化碳具有可燃性,二氧化碳不能燃烧,工业上
,可知它们都由碳元素、氧元素两种元素组成,但它们的化学性质不同,如一氧化碳具有可燃性,二氧化碳不能燃烧,工业上![]() 可用来炼铁,是利用它的还原性,化学方程式为:
可用来炼铁,是利用它的还原性,化学方程式为: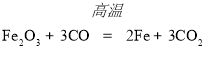 ;一氧化碳有毒,会污染空气,所以废气不能随意排放,处理方法是回收再利用或点燃;
;一氧化碳有毒,会污染空气,所以废气不能随意排放,处理方法是回收再利用或点燃;
(2) 铝具有良好的抗腐蚀性,是由于铝在空气中与氧气反应,在其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化,方程式为:![]() ;
;
(3) 洗涤剂具有乳化作用,能使衣服上的油污分散成无数细小的液滴随水流走,从而洗去油污,汽油能溶解衣服上的油污,而具有洗去油污的作用.
试题分析:(1)分子结构决定物质的性质,根据![]() 和
和![]() 都是由碳、氧元素组成,但是分子相差一个氧原子,则它们的化学性质不同;根据一氧化碳与氧化铁反应生成铁和二氧化碳书写方程式;根据一氧化碳有毒会污染空气,需要尾气处理分析;(2)根据铝在空气中与氧气反应,在其表面生成一层致密的氧化铝薄膜书写方程式;(3)根据洗涤剂具有乳化作用,汽油能溶解油污分析.
都是由碳、氧元素组成,但是分子相差一个氧原子,则它们的化学性质不同;根据一氧化碳与氧化铁反应生成铁和二氧化碳书写方程式;根据一氧化碳有毒会污染空气,需要尾气处理分析;(2)根据铝在空气中与氧气反应,在其表面生成一层致密的氧化铝薄膜书写方程式;(3)根据洗涤剂具有乳化作用,汽油能溶解油污分析.

 53随堂测系列答案
53随堂测系列答案【题目】(7分)某化学兴趣小组在探究Mg、Fe、Cu的性质时进行了如下图所示实验。

(1)实验一中,发生反应的化学方程式为 。
(2)实验二中,将实验一所得的物质倒入烧杯中,发现烧杯内的红色固体明显增多,充分反应后过滤。
①滤液中所含金属离子的成分可能是 (选填字母)。
A.Mg2+ B.Mg2+和Fe2+
C.Cu2+和Fe2+ D.Mg2+、Fe2+和Cu2+
②确定滤渣成分的实验方案如下:
操 作 | 现 象 | 结 论 |
取少量滤渣于试管中, 滴加 | 无明显现象 | 滤渣为 |
滤渣为 |
【题目】(一)实验室有一瓶标签如图所示的浓盐酸,要配制200g7.3%的盐酸,需要用该盐酸多少毫升?

(二)某校化学兴趣小组用所配制的稀盐酸,测定该某矿山上的石灰石样品中碳酸钙的质量分数,假设矿石中只含杂质二氧化硅(二氧化硅是一种极难溶于水也不与盐酸反应且耐高温的固体),他们取一块,将其粉碎后,称出11g放入烧杯内(烧杯的质量为20g), 然后加入100g所配制的稀盐酸,用玻璃棒搅拌至不再产生气泡为止,二者恰好完全反应,得到下列数据,请分析表格中的数据,回答下列问题。
反应前 | 反应后 | ||
实验 数据 | 烧杯和石灰石质量 | 加入盐酸质量 | 反应后混合物质量 |
31g | 100g | 126.6g | |
(1)生成二氧化碳的质量为多少?
(2)此石灰石样品碳酸钙的质量分数为多少;
(3)将反应后混合物过滤,将滤液蒸发掉多少克水后可得到某温度下氯化钙的饱和溶液(某温度下,氯化钙的溶解度为25克)(计算结果保留一位小数)
(4)若某石灰厂在矿山上开采出这样的矿石550吨,最后可得含杂质的生石灰多少吨?